酸素電極
光合成の速度を調べるためには様々な測定法がありますが(「光合成の測定」参照)、その中で、研究に使える精度を持ちながら比較的安価な機械のみで測定できるのが酸素電極による酸素発生活性の測定です。しかも、この方法は、単に光合成による酸素の発生を見るだけでなく、試薬の組み合わせを工夫することにより、光化学系Iや光化学系IIの活性を個別に測ることができます。以下、その原理と方法を見ていきましょう。
酸素電極の仕組み
酸素電極の原理
 酸素電極の電極部に飽和KCL溶液を満たし,陰極(白金)と陽極(銀)の間に電圧を印加すると、
酸素電極の電極部に飽和KCL溶液を満たし,陰極(白金)と陽極(銀)の間に電圧を印加すると、
陰極では酸素の還元が起こり,O2 + 4H+ + 4e- → 2H2O
陽極ではClが酸化され、4Ag + 4Cl- → 4AgCl + 4e-
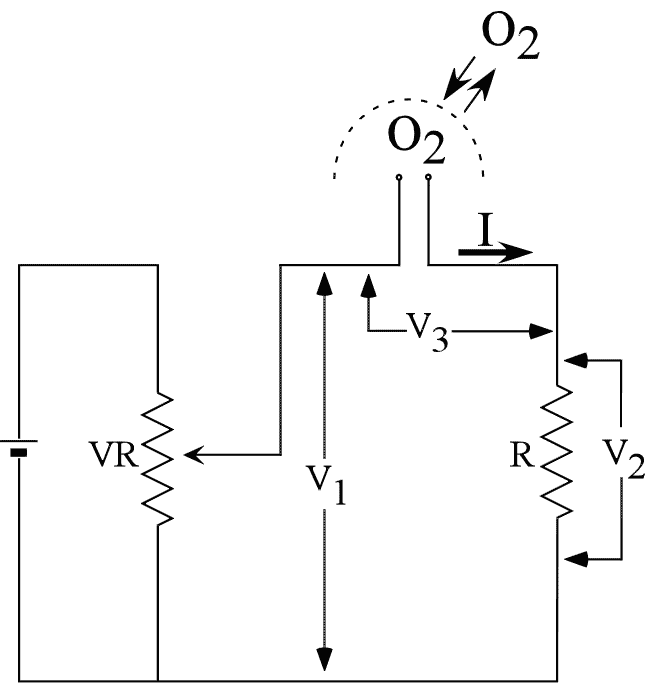
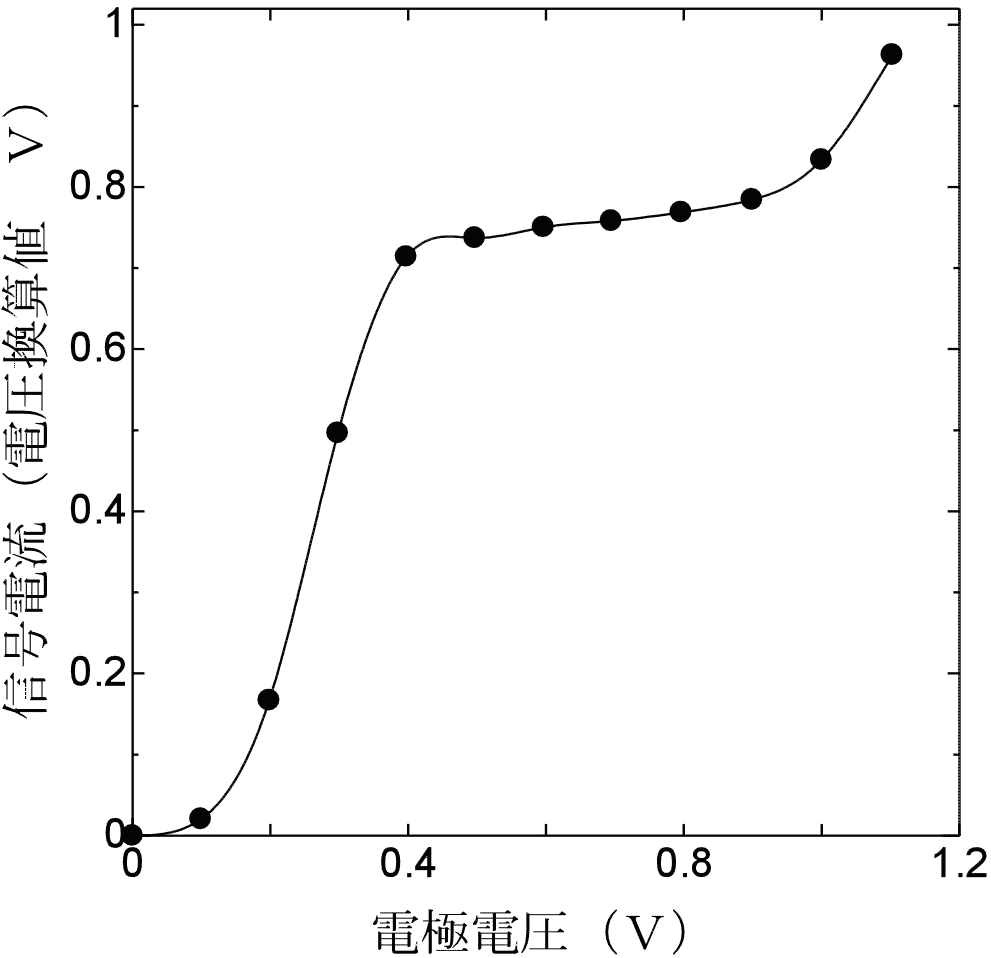
という反応とともに電流が流れます。この電流は溶液中の酸素濃度に比例するので、電流変化を測定することにより酸素濃度の変化を知ることができます。実際には右の上の図のような回路を用いて酸素電極に流れる電流を電圧に変換して測定します。ここでは、可変抵抗VRによって調節可能な電圧V1を回路にかけ、このV1から、抵抗Rによる電圧降下V2を差し引いたV3が酸素電極にかかる電極電圧となります。酸素電極の信号電流は、電極電圧によっても変化しますが(右下図)、0.4 Vから0.8 V付近の電極電圧では比較的変化が小さいので、電極電圧としては0.6 V付近を用います。V2は抵抗Rに電流Iが流れた時の電圧降下ですから、酸素電極に流れる電流(これが酸素濃度に比例します)は、このV2を測定することによって得ることができます。
 酸素電極の陰極は他の陽イオンとも反応し電流を流してしまうため、溶液中で直接反応を行うと液中のイオンの影響を受け、測定が不安定になります。このような影響を除去するため、酸素は通過させるがイオンを通さないテフロン膜で酸素電極を覆うことにより反応液と測定液を分離し、測定液の酸素濃度と平衡状態にある反応液の酸素濃度を測定するのがクラーク型の酸素電極の原理です。クラーク型の酸素電極にもいくつか種類がありますが、私達の研究室では、ランクブラザース、およびハンザテックという会社の酸素電極を使っています。クラーク型以外の酸素電極としては、試料を電極に直接接触させるジョリオ型の酸素電極があり、フラッシュによる酸素発生の周期振動を測定する場合などに使われます。
酸素電極の陰極は他の陽イオンとも反応し電流を流してしまうため、溶液中で直接反応を行うと液中のイオンの影響を受け、測定が不安定になります。このような影響を除去するため、酸素は通過させるがイオンを通さないテフロン膜で酸素電極を覆うことにより反応液と測定液を分離し、測定液の酸素濃度と平衡状態にある反応液の酸素濃度を測定するのがクラーク型の酸素電極の原理です。クラーク型の酸素電極にもいくつか種類がありますが、私達の研究室では、ランクブラザース、およびハンザテックという会社の酸素電極を使っています。クラーク型以外の酸素電極としては、試料を電極に直接接触させるジョリオ型の酸素電極があり、フラッシュによる酸素発生の周期振動を測定する場合などに使われます。
酸素電極からの信号の取り出し
 電極自体は数万円のもので、電極には電圧を印加しまた取り出すための2本のリード線がついています。ここに上記の約0.6 Vの電圧をかけると同時に、電流の変化を電圧の変化として取り出すことになります。この部分は酸素電極のコントローラーとして購入可能ですが、確か20万円などというお値段がついています。ハンザテックのシステムですと、パソコンへ出力するためのAD変換なども含めたトータルのセットで70万円弱になります。回路自体は、上の回路図のように、極めて単純なものですから、簡単に自作することも可能です。また、OPアンプなどを使えば、信号の増幅もできる回路を作ることができます。
電極自体は数万円のもので、電極には電圧を印加しまた取り出すための2本のリード線がついています。ここに上記の約0.6 Vの電圧をかけると同時に、電流の変化を電圧の変化として取り出すことになります。この部分は酸素電極のコントローラーとして購入可能ですが、確か20万円などというお値段がついています。ハンザテックのシステムですと、パソコンへ出力するためのAD変換なども含めたトータルのセットで70万円弱になります。回路自体は、上の回路図のように、極めて単純なものですから、簡単に自作することも可能です。また、OPアンプなどを使えば、信号の増幅もできる回路を作ることができます。
大気と平衡状態にある水に溶けている酸素の濃度(下の表1参照)は温度によって大きく変動しますから、酸素電極の試料室は、右の写真のように外側に恒温水を循環させ、温度が一定の条件で測定します。写真で、右からつきだしている先端の黒い棒は、光を照射するためのグラスファイバーです。酸素電極の下に見える銀色のものは溶液を撹拌するためのアクロバット・スターラーです。
溶けている酸素濃度に対して、光合成によって引き起こされる酸素濃度の変化は小さいため、酸素電極から取り出した電圧から、一定電圧を差し引き(バッキングといいます)、絶対値を小さくしてからレコーダーに入力することにより、レンジを拡大して記録できるようにします。レコーダーの中には、バッキング回路付きのものもありますので、そのようなものを使うと簡単です。電圧と酸素濃度の換算には、下の表1を使います。まず、大気中と平衡にある水の酸素電極の出力電圧を測定し、次に、還元剤であるジチオナイトを加えて酸素濃度を0にした状態で電圧を測定すれば、その電圧の差が表の中の酸素濃度に該当することがわかります。
※下の表は水平方向にスクロールできます。
| 表1 1気圧の空気と平衡になった蒸留水中の酸素濃度の温度依存性 according to Truesdale and Downing (1954) | |||||||||||
| 温度(℃) | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 |
| 酸素濃度(μM) | 442 | 386 | 341 | 305 | 276 | 253 | 235 | 220 | 206 | 192 | 176 |
酸素発生は、電子伝達に伴って光化学系IIの酸化側で起こります。そのため、炭酸固定系を欠いたチラコイド膜などで測定を行なう場合には、人工的な電子受容体を加える必要があります。下の表2に、代表的な電子受容体を挙げておきます。この中で、DCIPは酸化型は光化学系IIからの電子受容体として働きますが、アスコルビン酸などによって還元すると、系Iに対して電子供与体として働きます。
| 表2 代表的な電子受容体 | ||||
| 略称 | 電子受容部位 | 名称 | 溶媒 | ストック濃度 |
| DCBQ | PSII | 2,6-dichlorobenzoquinone | エタノール(メタノールでも) | 40 mM |
| DMBQ | PSII | 2,6-dimethylbenzoquinone | エタノール(メタノールでも) | 40 mM |
| pPBQ | PSII | phenyl-p-benzoquinone | エタノール(メタノールでも) | 40 mM |
| DCIP | PSII | 2,6-dichloroindophenol | 水 | 20 mM |
| MV | PSI | methyl viologen | 水 | 200 mM |
| フェリシアン化カリウム | PSII (and PSI) | potassium ferricyanide | 水 | 200 mM |
酸素電極による光化学系IIの活性測定
試薬:
系II電子受容体(表2参照)、酸素発生測定用バッファー:0.4 M Sucrose, 50 mM Mes/NaOH (pH 6.5), 10 mM NaCl, 5 mM MgCl2
手順:
1 mlの測定用バッファーに10μgChl/mlになるようにチラコイド膜を加え、酸素電極により光による酸素発生を見る。この際、0.4 mMフェニルベンゾキノン(酸化剤)を加える。電子受容体としてキノンを加えた場合は、水から光化学系IIを経てキノンへの電子伝達活性を見ることになり、光化学系IIにおける水の分解に伴う酸素発生が測定される。光化学系IIから直接電子がフェニルベンゾキノンに渡るため、光化学系Iなどの影響は受けない。電子伝達系に4電子流れた時に1分子の酸素が発生するので、電子当量として計算する時は、酸素発生活性の4倍の値となる。生物種や試料の種類によっては、フェニルベンゾキノン以外の電子受容体の方が活性が高い場合もあるので、初めての試料を測定する時は何種類か試してみた方がよい。電子伝達活性は、プロトン濃度勾配によって一種のフィードバック阻害を受けるので、脱共役剤(10 mMメチルアミンなど)を加えるとより高い活性が得られる場合がある。ただし、系II活性ではそれほど顕著ではない。
キノンは細胞膜を透過するので、シアノバクテリアの生細胞の光化学系II活性を、この方法で測ることも可能。ただし、その場合は、測定用バッファーの代わりにBG-11などの培養液を使用する。
酸素電極による光化学系Iの活性測定
試薬:
KCN(シアン化カリウム)、アスコルビン酸ナトリウム、DCIP(ジクロロフェノールインドフェノール)、DCMU、MV(メチルビオローゲン)酸素発生測定用バッファー:0.4 M Sucrose, 50 mM Mes/NaOH (pH 6.5), 10 mM NaCl, 5 mM MgCl2
手順:
1 mlの測定用バッファーに10μgChl/mlになるようにチラコイド膜を加え、さらに最終濃度1 mM KCN、1 mMアスコルビン酸ナトリウム、70μM DCIP、10μM DCMU、100μMメチルビオローゲンを加えて酸素電極により光による酸素濃度変化を見る。光化学系Iの場合は、むしろpH 7.5程度のバッファーを用いた方が、活性は安定するが、光化学系IIと異なり、pH依存性は小さいので、通常は、系IIの酸素発生測定に用いる測定用バッファーを共用している。電子伝達活性は、プロトン濃度勾配によって一種のフィードバック阻害を受けるので、脱共役剤(10 mMメチルアミンなど)を加えるとより高い活性が得られる場合がある。ただし、系I活性ではそれほど顕著ではない。
メチルビオローゲンは系Iからのみ電子を受け取ることができ、この還元型のメチルビオローゲン1分子は酸素1分子を還元する。系Iに4電子流れた場合、還元された4分子の酸素は、2分子の過酸化水素と2分子の酸素になる。KCNは、過酸化水素を分解する酵素の阻害剤として加えている。還元された酸素は酸素電極では捉えることができないので、結局、4電子流れるごとに2分子の酸素が吸収されることになる。従って、電子当量としては、酸素発生の?2倍の値となる。この測定では、DCMUを加えることにより、光化学系IIと酸素発生を阻害し、アスコルビン酸で還元したDCIPを加えることによって、電子を系Iに供与している。このため、光化学系IIの活性とは別個に光化学系Iの活性を測定していることになる。
この測定をシアノバクテリアの生細胞に応用した例もあるが、電子供与体として用いるDCIPやDADの細胞膜透過性は低く、実際には最大活性を測定することはできない。ストレスなどによって膜透過性が上がると、見かけ上、光化学系Iの活性の上昇として観察されることもあるので、あまりお勧めしない。
酸素電極による全電子伝達活性の測定
試薬:
KCN(シアン化カリウム)、MV(メチルビオローゲン)、酸素発生測定用バッファー:0.4 M Sucrose, 50 mM Mes/NaOH (pH 6.5), 10 mM NaCl, 5 mM MgCl2
手順:
1 mlの測定用バッファーに10μgChl/mlになるようにチラコイド膜を加え、さらに最終濃度1 mM KCN、100μMメチルビオローゲンを一緒に加えて酸素電極により光による酸素濃度変化を見る。この測定方法では、水の分解によって生じた電子が、光化学系II、光化学系Iを経由してメチルビオローゲンに渡される。電子伝達系に4電子流れると、光化学系IIで1分子の酸素が発生し、光化学系Iで2分子の酸素が吸収されるため、全体としては、4電子あたり、1分子の酸素が吸収されることになる。従って、電子当量としては、酸素発生の4倍の値となる。電子伝達活性は、プロトン濃度勾配によって一種のフィードバック阻害を受けるので、脱共役剤(10 mMメチルアミンなど)を加えるとより高い活性が得られる。全電子伝達活性の測定はプロトンの輸送に働くシトクロームb/f複合体を経由する活性を測定していることになるので、脱共役剤の効果は顕著に表れる。
メチルビオローゲンは細胞膜を透過するので、シアノバクテリアの生細胞の光化学系I活性を、この方法で測ることも可能。ただし、その場合は、測定用バッファーの代わりにBG-11などの培養液を使用する。
Oxygraphによる測定プロトコール
ハンザテック社のOxygraphは、光合成測定システムとして組まれた酸素電極として一般的な測定装置です。この装置の測定プロトコールについては、Oxygraphによる酸素発生の測定をご覧ください。
酸素電極の測定方法と測定原理については、共立出版の「光合成研究法」(加藤栄ら編)に詳しく載っているのですが、版元品切れかも知れません。現在は、北大低温研で出した「光合成研究法」に岡山大学の沈さんが解説を書いています。これは、自由にダウンロード可能です。