光合成と私たちの研究
光合成の研究は何を目指しているのか?
緑色植物は光合成を行っています。光合成は光のエネルギーを利用して大気中の二酸化炭素を有機物に変える反応です。光合成は生きてゆくための大部分のエネルギーと大部分の物質を私たちに供給してくれます。動物は光合成をしませんが、エネルギーや物質を植物からとるか、植物に依存している他の生物からとっています。このようにして地球上のすべての生き物−植物、動物、細菌など−は、ほんのわずかな例外を除いて、太陽の光エネルギーとそれによって駆動される光合成に依存して生きています。
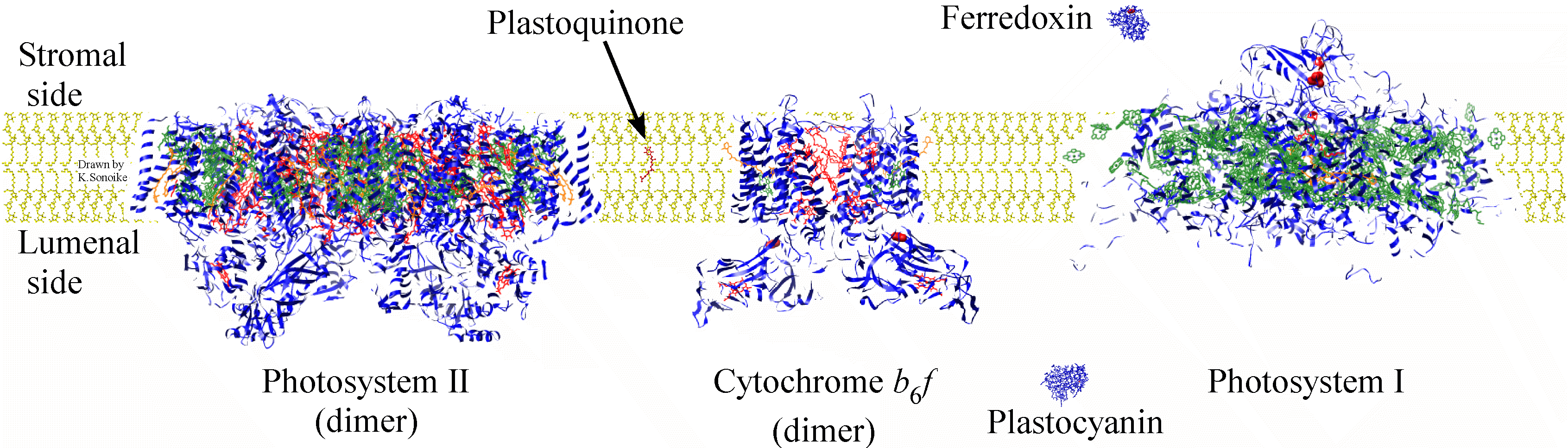
光合成研究の歴史は非常に古く、プリーストリーによる酸素の発見(1771年)などもその一つとして考えることができます。光合成のプロセスは、光によってエネルギー(ATP)と還元力(NADPH)の生成する光化学反応と、ATPとNADPHを使って二酸化炭素を固定する炭酸固定反応に分けられます。下の図には、葉緑体のチラコイド膜において光化学反応に関与する複合体の主なものを示しています。過去の研究の積み重ねによって光合成の主要な反応経路や各複合体のサブユニット組成などが詳細に調べられ、主な構成タンパク質の遺伝子はほとんどがクローニングされています。それではこれ以上光合成を研究する余地があるのでしょうか?
私たちは今や光合成というゲームのほとんどすべてのプレイヤーを知っています。次の問題はゲームのルール自体だと思います。どのように、光合成の精巧な仕組みはできあがっていくのでしょう?そして植物はどうやって違う環境に順化して光合成の仕組みを変化させていくのでしょう?また、どのように現在の環境に適応・進化してきたのでしょうか?私たちの研究室ではこのような疑問に答えるべく研究しています。
研究の概要
1.植物の環境応答システムの分子生物学的研究(ポストゲノム的研究)
高等植物における分子生物学的研究の主流は現在シロイヌナズナになっていますが、光合成の環境応答に関する研究がシロイヌナズナで行われた例はきわめて限られます。これは主に、光合成の研究が生化学を中心にして発達してきたのに対して、シロイヌナズナの個体がきわめて小さいため生化学的な解析に適さないことによるのでしょう。しかし、現在では研究手法の発達に伴って、PAMによる蛍光の測定などを用い個体そのもので光合成を非破壊的に解析することが可能となってきました。このような状況の下で、現在シロイヌナズナ、および植物のモデル生物としてのシアノバクテリア(ラン藻)を用いて光合成を含めた環境応答システムの研究を行っています。具体的には、以下の2つのプロジェクトが進行中です。
1)シアノバクテリアゲノムにコードされた遺伝子産物機能の網羅的解析
 現在までに数多くの生物において、全ゲノムのシークエンスが完了し、その網羅的解析が進行中です。光合成のモデル生物として非常に重要な位置をしめるシアノバクテリア Synechocystis においても、かずさDNA研究所によってその全ゲノムのシークエンスが完了し、ゲノムがコードする遺伝子の数はおよそ3,000と見積もられています。シアノバクテリアは原核生物でありながら酸素を発生する高等植物型の光合成を行います。その中でもSynechocystisはDNAを細胞に取り込んで組換えを起こす性質があるため遺伝子破壊株を作成することが容易で、遺伝子の機能解析を目的にすでに数多くの破壊株が作成されています。また、トランスポゾンを利用して、全ての遺伝子の破壊株の作成も可能になっていますが、その表現型の解析の方が追いつかない状況になっています。本プロジェクトにおいてはクロロフィル蛍光の2次元画像の時間変化を用いて蛍光の時間変化を解析することにより、さまざまな遺伝子破壊株の表現型を網羅的に解析する手法の確立を目指しています(右の写真は2次元蛍光カメラの装置の外観)。この新たに開発された方法を用いて、シアノバクテリアのゲノムがコードする遺伝子のすべての破壊株の表現型を解析することによって、シアノバクテリアのゲノム機能を明らかにすることを最終的な目的としています。
現在までに数多くの生物において、全ゲノムのシークエンスが完了し、その網羅的解析が進行中です。光合成のモデル生物として非常に重要な位置をしめるシアノバクテリア Synechocystis においても、かずさDNA研究所によってその全ゲノムのシークエンスが完了し、ゲノムがコードする遺伝子の数はおよそ3,000と見積もられています。シアノバクテリアは原核生物でありながら酸素を発生する高等植物型の光合成を行います。その中でもSynechocystisはDNAを細胞に取り込んで組換えを起こす性質があるため遺伝子破壊株を作成することが容易で、遺伝子の機能解析を目的にすでに数多くの破壊株が作成されています。また、トランスポゾンを利用して、全ての遺伝子の破壊株の作成も可能になっていますが、その表現型の解析の方が追いつかない状況になっています。本プロジェクトにおいてはクロロフィル蛍光の2次元画像の時間変化を用いて蛍光の時間変化を解析することにより、さまざまな遺伝子破壊株の表現型を網羅的に解析する手法の確立を目指しています(右の写真は2次元蛍光カメラの装置の外観)。この新たに開発された方法を用いて、シアノバクテリアのゲノムがコードする遺伝子のすべての破壊株の表現型を解析することによって、シアノバクテリアのゲノム機能を明らかにすることを最終的な目的としています。
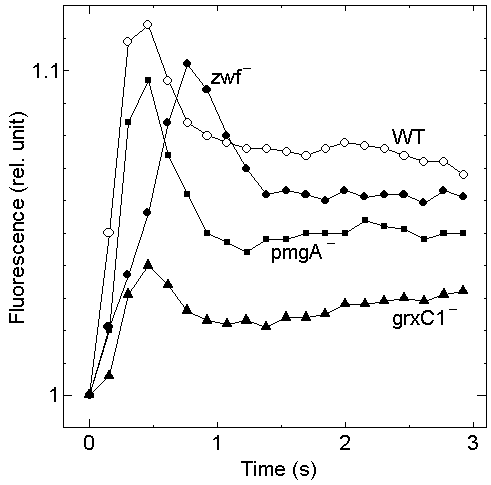
 現在までにシアノバクテリアの遺伝子破壊株36種について2次元蛍光画像解析システムによる測定を行ないました(左の図は、プレート上のシアノバクテリアの蛍光画像。細胞のある領域が自動認識され、その領域の蛍光強度によって色分けされている)。その結果、グルコース6リン酸脱水素酵素、NADH脱水素酵素、グルタレドキシンなど、光合成に直接関与しない酵素の欠損株においても、蛍光強度の時間変化に明瞭な差が見られることが明らかになりました(右のグラフはいくつかの変異株の蛍光の時間変化を示す)。これは、蛍光を非光合成遺伝子の機能解明に用いた世界でも最初の例であると考えています。基本的には、蛍光の極大の位置、極大の大きさ、最終的な蛍光強度などの項目により、多くの変異株をクラス分けすることが可能であることを見いだしました。その後の研究の進展に関してはFluoromeプロジェクトをご覧下さい。
現在までにシアノバクテリアの遺伝子破壊株36種について2次元蛍光画像解析システムによる測定を行ないました(左の図は、プレート上のシアノバクテリアの蛍光画像。細胞のある領域が自動認識され、その領域の蛍光強度によって色分けされている)。その結果、グルコース6リン酸脱水素酵素、NADH脱水素酵素、グルタレドキシンなど、光合成に直接関与しない酵素の欠損株においても、蛍光強度の時間変化に明瞭な差が見られることが明らかになりました(右のグラフはいくつかの変異株の蛍光の時間変化を示す)。これは、蛍光を非光合成遺伝子の機能解明に用いた世界でも最初の例であると考えています。基本的には、蛍光の極大の位置、極大の大きさ、最終的な蛍光強度などの項目により、多くの変異株をクラス分けすることが可能であることを見いだしました。その後の研究の進展に関してはFluoromeプロジェクトをご覧下さい。
2)シロイヌナズナにおける環境応答変異株の単離
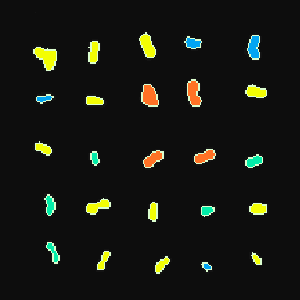 上記のクロロフィル蛍光の2次元画像の解析は、シロイヌナズナの遺伝子変異株のスクリーニングにも応用できます。従来も、光合成に関する変異株を蛍光強度の増大としてとらえるスクリーニング方法がありましたが、従来の方法では、光合成系に重大な障害がある変異株しか単離できません。私たちは蛍光の時間変化を2次元で解析することにより、生育は野性株と全く同じであるが光合成系に微妙な影響が出ている変異株をもスクリーニングできるのではないかと考えて研究を進めています。現在までに蛍光の時間変化に異常のある変異株を1つ単離していますが、これは生育速度も野性株とは異なっていました。より微妙な変異を持つ変異株を現在スクリーニング中です。また、このような微妙な影響を検知できると、通常の条件では全く野性株と同じ表現型を持つが、環境変化にさらされた際にのみ表現型を示すような変異株をスクリーニングすることができるはずです。これに関しても、低温傷害の研究と絡めて研究を進行しています(左はシロイヌナズナの芽生えの蛍光画像)。
上記のクロロフィル蛍光の2次元画像の解析は、シロイヌナズナの遺伝子変異株のスクリーニングにも応用できます。従来も、光合成に関する変異株を蛍光強度の増大としてとらえるスクリーニング方法がありましたが、従来の方法では、光合成系に重大な障害がある変異株しか単離できません。私たちは蛍光の時間変化を2次元で解析することにより、生育は野性株と全く同じであるが光合成系に微妙な影響が出ている変異株をもスクリーニングできるのではないかと考えて研究を進めています。現在までに蛍光の時間変化に異常のある変異株を1つ単離していますが、これは生育速度も野性株とは異なっていました。より微妙な変異を持つ変異株を現在スクリーニング中です。また、このような微妙な影響を検知できると、通常の条件では全く野性株と同じ表現型を持つが、環境変化にさらされた際にのみ表現型を示すような変異株をスクリーニングすることができるはずです。これに関しても、低温傷害の研究と絡めて研究を進行しています(左はシロイヌナズナの芽生えの蛍光画像)。
2.光合成生物の光環境への順化・適応・進化の研究
光合成生物は、その生育のエネルギーとして光を必要としますが、一方で光環境の変動の幅はきわめて大きいため、しばしば過剰な光に対して対策を講じる必要が生じます。私たちは、pmgAと名付けられた光化学系量比を調節する遺伝子が破壊されたシアノバクテリアの変異株では、短期間の強光に対して野生株よりもかえって強くなっていることを見いだしました。pmgAの変異株は、もともと野生株から自然突然変異で現れたものでしたが、実験室内で強光で培養しているうちに、野生株に対して優先し、最後には全てが変異株に置き換わってしまいました。つまり、強光で培養を続けるうち、環境により適応した変異株が出現し、最後に野生株に置き換わるという、一種の進化の過程を研究室内で再現することができたわけです。進化の過程は、通常実験的に確かめることが難しいのですが、シアノバクテリアのような生物では、このような形で進化を研究することが可能です。ちなみに、pmgA変異株は連続的な強光条件では死滅することから、強光への順化に関わる遺伝子であると考えています。私たちの研究室では、光条件の変動に対する順化・適応・進化といった現象を、シアノバクテリアの変異株を利用して研究しています。この部分は、埼玉大学の日原グループとの 共同研究です。
この他、1に述べた2次元蛍光画像解析システムによって、最近、pmgA変異株と同様に、光化学系量比を調節をできない変異株を単離することができました。この変異株の原因遺伝子(sll1961)は転写因子様のタンパク質をコードしており、強光順化のシグナル伝達を解明する上で、突破口になるのではないかと考えています。面白いことに、このsll1961変異株は、もう一つの強光応答である、フィコビリゾームというアンテナの強光下での減少にも欠損があり、さらに、窒素欠乏によるフィコビリゾームの分解という、強光応答とは一件無関係に見える減少にも欠損を示しました。ことのことは、実は、光化学系量比の調節が、窒素代謝と何らかの関わりを持っている、という全く新しい概念を提起しています。
 一方、シアノバクテリアは、光化学系量比の調節の他に、ステート遷移という強光応答を示します。ステート遷移は、通常、光化学系IIのアンテナとして働くフィコビリゾームからのエネルギーが、光化学系Iにも渡るようになる、というエネルギーの分配を変化させる調節系です。我々の研究室では、このステート遷移に、光化学系IのサブユニットであるPsaK2が関わっていることを突き止めました。シアノバクテリアの光化学系Iには、PsaK1とPsaK2というよく似たサブユニットがあるのですが、PsaK1は常に発現しているのに対して、PsaK2は細胞を強光にさらすと発現して複合体に組み込まれます。このような、サブユニットの組み込みによってステート遷移が起こるという発見は、強光応答の仕組みを考える上で、極めて重要な発見でした。右の図のようにシアノバクテリアのPsaKの位置と、高等植物におけるPsaKとそれと相同のPsaGの位置を考えると、高等植物のPsaGの位置はシアノバクテリアの場合は空白となっており、強光条件下ではこの位置にPsaK2が組み込まれるのかも知れません。
一方、シアノバクテリアは、光化学系量比の調節の他に、ステート遷移という強光応答を示します。ステート遷移は、通常、光化学系IIのアンテナとして働くフィコビリゾームからのエネルギーが、光化学系Iにも渡るようになる、というエネルギーの分配を変化させる調節系です。我々の研究室では、このステート遷移に、光化学系IのサブユニットであるPsaK2が関わっていることを突き止めました。シアノバクテリアの光化学系Iには、PsaK1とPsaK2というよく似たサブユニットがあるのですが、PsaK1は常に発現しているのに対して、PsaK2は細胞を強光にさらすと発現して複合体に組み込まれます。このような、サブユニットの組み込みによってステート遷移が起こるという発見は、強光応答の仕組みを考える上で、極めて重要な発見でした。右の図のようにシアノバクテリアのPsaKの位置と、高等植物におけるPsaKとそれと相同のPsaGの位置を考えると、高等植物のPsaGの位置はシアノバクテリアの場合は空白となっており、強光条件下ではこの位置にPsaK2が組み込まれるのかも知れません。
3.光合成反応の素過程から捉えた高等植物の低温障害の分子機構の研究

熱帯から亜熱帯に原産地をもつ植物は寒さに弱いことが知られています。このことは農業的にも重要であるため古くから研究されていましたが、その原因がどこにあるのかについては長らく甲論乙駁の状態が続いていました。キュウリ、トマトやインゲンなどでは、10℃ぐらいを境に急に光合成が低下してしまい生育が阻害されます。この現象は暗所ではきわめて起こりにくいことがわかり一種の光阻害と考えることが出来ますが、阻害に必要な光は太陽光の1/20程度ときわめて弱く、一般的に知られている光阻害とはかなり異なることが予想されます。私たちのグループはこの現象を詳しく解析した結果、以下に示すような点を明らかにしました。
1)阻害は系Iに特異的で、生葉での阻害には低温と酸素が必要である。
2)阻害に系IIの強光阻害のような非生理的な強光を必要としない。
3)レーザー分光や電子スピン共鳴を用いた測定から、阻害は系I結合電子受容体の失活、反応中心クロロフィルの破壊、反応中心サブユニットの分解という3段階を経る。
4)低温耐性の植物でも、チラコイド膜を単離すると同様な傷害が起こる。つまり、低温を感受する部位と実際に傷害が起きる部位が異なる。
5)阻害には系I反応中心サブユニットの一つであるPsaBの分解を伴い、阻害、分解共に活性酸素消去剤によって
抑制される。
このように、植物の低温感受性に光化学系Iの光阻害が深く関わっていることが示され、活性酸素消去系との関連も含めて、植物のストレス応答に全く新しい局面が切り開かれました。従来光化学系Iはきわめて安定で阻害を受けないとされ、上記のような現象は全く予想外のものでした。これまで、低温障害、光化学系I、光阻害、活性酸素消去系といった研究テーマはそれぞれ研究者の興味を引きつけてきましたが、熱帯原産の植物など低温に弱い植物が低温環境下で生育できない原因が、「低温」−「活性酸素消去系の失活」−「光化学系Iの保護機構の喪失」−「光化学系Iの光阻害」というカスケードによるのではないかとの可能性がこれで示されたことになります。このことは、低温感受性部位における変化がそのまま傷害となってあらわれると考えがちであった従来の研究方向に修正を迫るもので、今後は、実際に低温を感受する部位の探索を行っていきたいと考えています。