オンライン教科書
パルス変調とクロロフィル蛍光を用いた光合成の測定ー理論編ー
Last revised on January 30, 2003
著作権者:園池公毅
蛍光とは光を吸収した色素が、そのエネルギーを再び光として放出する現象の一つで、蛍光灯がその応用例としてはもっとも身近でしょう。光合成は色素による光エネルギーの吸収から始まりますから、蛍光とは切っても切れない縁があります。ここでは、蛍光についての一般論のあと、光合成における蛍光測定の利用、特に最近発達しているパルス変調による蛍光測定の実際までを説明します。最初の方の物理的な説明は、必ずしも、生物学的な応用には必要ないので、読み飛ばしても構いませんが、大筋を理解しておくことは損にならないでしょう。より実際の測定に即した解説は、測定編として現在執筆中です。
なお、この教科書は、WEBで公開する蛍光と光合成の教科書ですが、著作権は放棄していません。自由に、ご覧になり、プリントアウトしても構いませんが、個人としての利用に限ります。個人以外の利用は園池までご相談下さい。また、随時、修正・加筆を行いますので、この教科書を人に教える際は、プリントアウトを渡すのではなく、アドレスを教えるようにしてください。アドレスは
https://www.photosynthesis.jp/fluo1.html
です。2003年のお正月に「7.3系Iの実効量子収率」の項を足しました。この他、測定編を https://www.photosynthesis.jp/fluo2.html にアップロードしましたが、まだ執筆中で未完成です。
目次
1.蛍光の一般論
1)蛍光の定義
2)蛍光とその他の発光
2.クロロフィルの蛍光
1)蛍光の収率
2)光エネルギーの行方とFv/Fmの意味
3.クロロフィル蛍光のスペクトル
1)室温での蛍光スペクトル
2)低温での蛍光スペクトル
4.蛍光の誘導期現象
1)誘導期現象の概略
2)DCMU存在下での蛍光誘導と系IIの不均一性
5.ポンプ&プローブ法による蛍光測定
1)ポンプ&プローブ法とは
2)ポンプ&プローブ法の実際
6.パルス変調による蛍光測定
1)パルス変調とは
2)飽和パルス光の意味
3)Quenching Analysis
4)蛍光挙動の定量化 qNとqP
5)蛍光パラメーターφII、ETRとその解釈
6)非光化学消光の原因
7)その他のパラメーター NPQとExcess
8)シアノバクテリアにおける蛍光変化
9)シアノバクテリアのqNと光環境
7.パルス変調による吸収測定
1)吸収測定の原理
2)P-700の測定
3)系Iの実効量子収率
1.蛍光の一般論
1)蛍光の定義
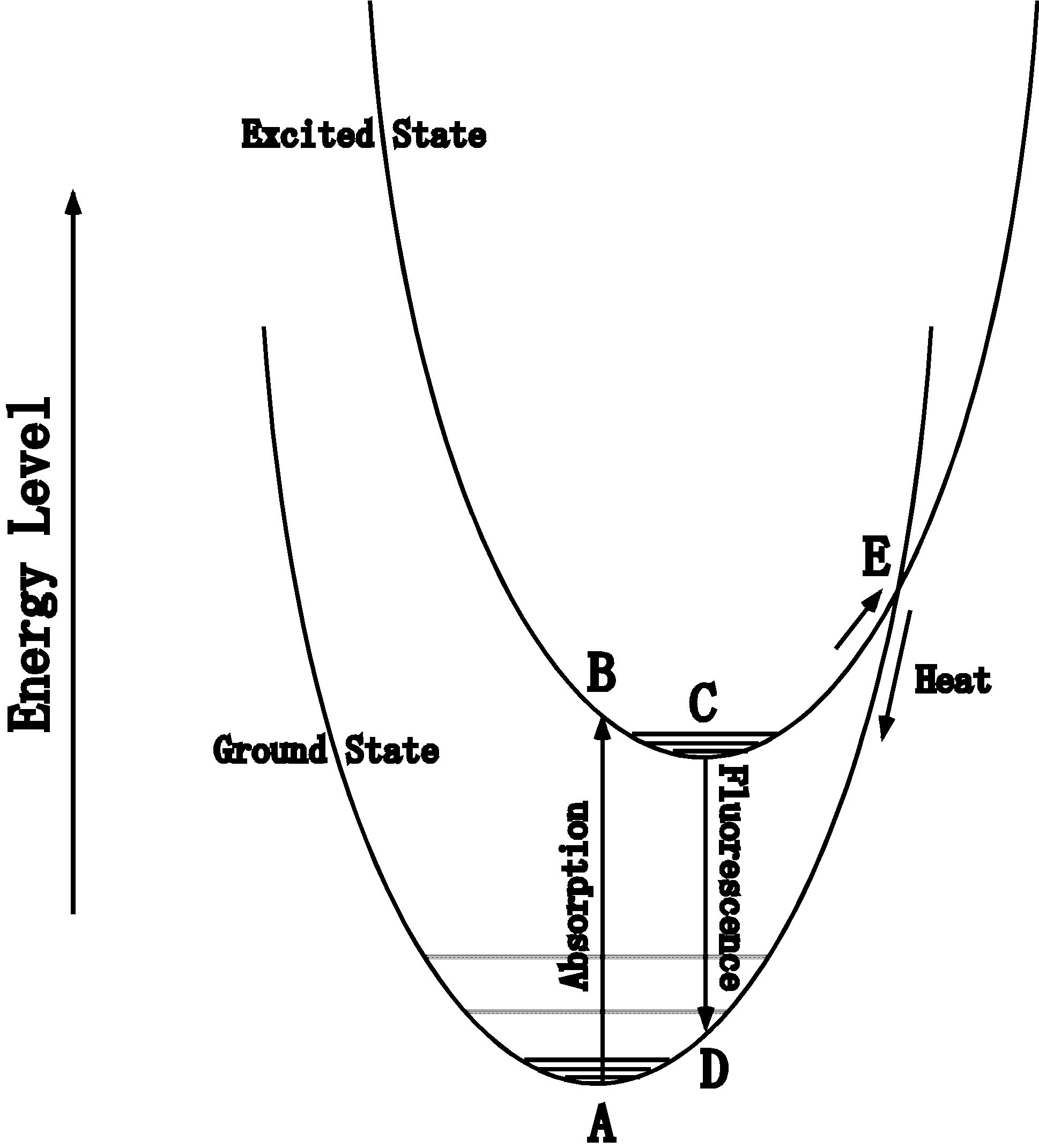 色素は光を吸収するとエネルギーの低い安定な基底状態からエネルギーの高い励起状態になります。可視光の吸収では電子準位間の移動(=励起)になります。横軸に原子内の位置座標、縦軸にエネルギーレベルをとった図で電子順位を示すと、基底状態は右図下側の放物線、励起状態はその上の放物線になります。基底状態では、電子は熱エネルギーによっていくつかの回転・振動準位などを取りますが、おおざっぱにはエネルギーの低い放物線の底(図のA点)近くにあり、光エネルギーを吸収すると、励起状態のB点まで励起されます。B点は励起状態の底ではないので、熱を放出しながらC点まで動きます。これを
Internal Conversion といっています。C点から基底順位のD点にもう一度落ちるときにその差の分のエネルギーが光として放出されるのが蛍光です。D点からA点へのInternal
Conversionでの動きも熱になります。1863年にStokes
は、単離色素の発光スペクトルは励起光の波長によらず、一番長波長の吸収と同じか、より長波長側に来ることを観察しています。これは、高いエネルギー状態に励起されても、まず図のC点まで熱的に落ちてから蛍光が出ること意味しています。熱になった部分のエネルギーは蛍光になりませんから、蛍光のエネルギーは常に吸収された光のエネルギーより低い(つまり波長にすれば長い)ことになります。ちなみに、反応中心で電荷分離が起こった場合は、その電子は反応中心から別の受容体に移りますから、原子内の電子準位の図からは飛び出すことになります。
色素は光を吸収するとエネルギーの低い安定な基底状態からエネルギーの高い励起状態になります。可視光の吸収では電子準位間の移動(=励起)になります。横軸に原子内の位置座標、縦軸にエネルギーレベルをとった図で電子順位を示すと、基底状態は右図下側の放物線、励起状態はその上の放物線になります。基底状態では、電子は熱エネルギーによっていくつかの回転・振動準位などを取りますが、おおざっぱにはエネルギーの低い放物線の底(図のA点)近くにあり、光エネルギーを吸収すると、励起状態のB点まで励起されます。B点は励起状態の底ではないので、熱を放出しながらC点まで動きます。これを
Internal Conversion といっています。C点から基底順位のD点にもう一度落ちるときにその差の分のエネルギーが光として放出されるのが蛍光です。D点からA点へのInternal
Conversionでの動きも熱になります。1863年にStokes
は、単離色素の発光スペクトルは励起光の波長によらず、一番長波長の吸収と同じか、より長波長側に来ることを観察しています。これは、高いエネルギー状態に励起されても、まず図のC点まで熱的に落ちてから蛍光が出ること意味しています。熱になった部分のエネルギーは蛍光になりませんから、蛍光のエネルギーは常に吸収された光のエネルギーより低い(つまり波長にすれば長い)ことになります。ちなみに、反応中心で電荷分離が起こった場合は、その電子は反応中心から別の受容体に移りますから、原子内の電子準位の図からは飛び出すことになります。
電子が励起状態から基底状態に落ちるときに蛍光を必ず出すとは限らず、余分なエネルギーを全て熱として放出することもあります。これは、図のE点を通る経路を考えると直感的に理解できます。E点は通常C点よりエネルギー的に高いところにありますが、ここにあがるには熱エネルギーが必要です。従って、熱になる割合は温度が高いほど大きく、蛍光強度は逆に温度を下げると強くなります。後述するキサントフィルによる熱放散などでは、このような形でエネルギーが熱になります。
身近な蛍光の応用例に、蛍光灯があります。クリーンベンチなどで使う紫外線ランプは、管が透明で、紫外線が放射されます。蛍光灯は、この紫外線ランプの管の内側に蛍光物質が塗ってあります。蛍光物質は紫外線によって励起され、可視光を蛍光として発光します。つまりここでも、吸収波長は蛍光波長より短いという蛍光の原理がわかります。
2)蛍光とその他の発光
参考までに、蛍光以外にどのような発光があるかを見てみましょう。励起状態の物質が、いったん、三重項と呼ばれる状態になってから蛍光よりももっとエネルギーの低い長波長の光を出して基底状態に戻るときの発光を燐光といいます。三重項状態から基底状態へは電子が移りにくいため、燐光の寿命は長く、長いときは何秒間も光り続けます。これに対して蛍光の寿命は通常10-6〜10-12秒で、光合成系のクロロフィルなどではピコ(10-12)からナノ(10-9)秒のレベルです。
光合成の反応中心では、光エネルギーが電荷分離に使われます。分離したエネルギーの高い電荷が再結合すると色素の一部は再び励起状態になりますから、基底状態に落ちるときに、蛍光を放出する場合があります。これを遅延蛍光といいます。電荷が分離した状態は集光性色素の励起状態より安定なので、遅延蛍光の寿命は、蛍光に比べると長く、これが「遅延」蛍光と呼ばれる由来です。ある一定の温度以下では、電荷分離状態は非常に安定になり、そのまま再結合しなくなります。温度を徐々に上げていくことで、特定の温度で電荷分離状態に応じた再結合がおこり、発光が見られます。これを熱発光といいます。遅延蛍光、熱発光、共に、電荷分離状態に関する情報を与えてくれるため、光合成の反応中心の研究に用いられてきました。
なお、古くはクロロフィルの蛍光発光に電荷分離が関与しているとの説も提出されていました。フェオフィチンが系IIの初期電子受容体であることを確立した Klimov は、フェオフィチンの次の系II電子受容体であるQAが還元された状態で光が当たると、P-680+Pheo−という電荷分離状態が生じると考えました。そして、このような電荷分離状態から逆反応(電荷の再結合)によって再励起されたP-680*もしくはその近傍のクロロフィルが蛍光を発するとしました。また Breton はQA が還元された系IIにおいて励起されたフェオフィチンから液体窒素温度で695 nmに現れる蛍光が発光するとしました。
このようなモデルに対して、QAが還元された状態では電荷分離が非常に遅くなること、電荷の再結合にはナノ秒レンジの時間が必要で、ピコ秒の蛍光には遅すぎることから、現在ではアンテナクロロフィルから直接蛍光がでており、電荷分離は直接関与していないとの説が一般的です。純化したQAのない光化学系II反応中心(D1・D2・b559)では数十nsの蛍光成分がみられ、電荷再結合によるとされていますが、正常な光合成系では観察されません。また695 nmに現れる蛍光は光化学系IIの内部アンテナであるCP47から発光することが確立されています。
2.クロロフィルの蛍光
1)蛍光の収率
ある色素が光を吸収し蛍光を出す場合、吸収と発光の光子数の比を、蛍光の量子収率といいます。例えば、有機溶媒中のクロロフィルの蛍光の収率は一般に30%程度です。ここで、量子収率といっているのは、光子の数で数えているためです。収率は、エネルギーについても計算できますが、蛍光は吸収光より長波長なので(蛍光の光子1個のエネルギーは吸収光の光子1個のエネルギーより小さいので)、常に、「蛍光のエネルギー収率<蛍光の量子収率」となります。
実際の光合成系では、光のエネルギーは電荷分離に使われるので、クロロフィルの蛍光の収率は非常に低く、通常3%以下です。2つある光化学系のうち、室温では、光化学系Iはほとんど蛍光を出さず、蛍光は主に光化学系IIから発せられます。光化学系IIからの蛍光は、光化学系IIの電子受容体であるQAが酸化されているとき(光化学系IIがopenであるといいます)と還元されているとき(光化学系IIがcloseであるといいます)で収率が違います。系IIがcloseのときは蛍光収率は3%程度ですが、openになると収率は0.6%程度まで下がります。
2)光エネルギーの行方とFv/Fmの意味
色素に吸収された光エネルギーは、もちろん蛍光になるだけではありません。弱光最適条件下での光合成の量子収率は90%以上にもなりますから(光化学反応に限れば99%以上)、そのような条件では、光エネルギーの大部分は光合成に使われることになります。また、エネルギーの一部は熱になります。その他の場合として、別の色素にエネルギーを渡す場合が考えられますが、この場合は、移動した先で、いずれは蛍光になるか、熱になるか、光合成に使われるわけですから、関係する色素をまとめて考えれば無視することができます。
そこで、このようなエネルギーの関係を見やすく式に書いてみましょう。まず、Fを蛍光の強度とします。蛍光の強度というのは「時間あたりに放出される光子の数」とも言えますから、蛍光の光子放出の反応速度と考えることができます。
F:蛍光強度(光子放出の反応速度)
次に、色素が吸収する光の量をIaとしましょう。蛍光の強度は生物現象を考える上では、色素が吸収した光量に比例します。従って、
F∝Ia (式1)
となります。ここで、蛍光の収率をφFとすると、収率は前述のように、蛍光量を吸収光量で割ったものですから、
φF=F/Ia (式2)
となります。つまり、式1の比例定数がφFであったということです。さて、蛍光以外にエネルギーは、光合成に使われたり、熱になったり、他の色素に移動したりします。これらは、お互いに競争反応で、速度が速い反応経路にエネルギーが多く流れるはずです。蛍光になる反応速度、光合成に使われる反応速度、熱になる反応速度、他の色素に移動する反応速度を、それぞれ、kF、kP、kD、kTとすると、
φF=kF/(kF+kP+kD+kT) (式3)
となるはずです。つまり、どれだけが蛍光になるかは全体の反応速度の中で、蛍光の反応速度がどれだけ速いかによって決まるということです。さてここで、蛍光の収率と光合成の状態の関係を考えてみましょう。他の条件(熱になる速度kDと他の色素に流れる速度kT)が変化しないと考えた場合、光合成が働かない時(式3でkPが0の時)に蛍光の収率φFは最大値φFMを取るはずです。一方、光合成速度が最大の時(kP=kPm)、蛍光の収率は最小値φF0を取ります。ここで、今度は光合成の収率φPの最大値φPmを考えると
φPm=kPm/(kF+kPm+kD+kT) (式4)
となります。次に、おそらく蛍光のパラメーターの中で一番有名なFv/Fmを考えてみます。Fmは蛍光強度の最大値で、Foが蛍光強度の最小値、FvはFm−Foです。Fは蛍光の強度自体ですが、Fv/Fmは比の形になっていますから、収率の比に書き換えることもできます。
Fv/Fm=(Fm−Fo)/Fm=(φFM−φFO)/φFM (式5)
ここで、式5に式3をkPの値を考えながら代入すると
Fv/Fm={kF/(kF+kD+kT)−kF/(kF+kPm+kD+kT)}/{kF/(kF+kD+kT)}
=1−(kF+kD+kT)/(kF+kPm+kD+kT)
={(kF+kPm+kD+kT)−(kF+kD+kT)}/(kF+kPm+kD+kT)
=kPm/(kF+kPm+kD+kT) (式6)
この式6の右辺は式4の右辺と同じですから結局、
φPm=Fv/Fm (式7)
となります。つまり、Fv/Fmは光合成の最大収率を示すわけです。このFv/Fmは測定が簡便で、生葉などのインタクトな試料を用いて求めることができるため、非常に広く使われています。高等植物では、最適条件で0.83程度の値を与えます。酸素発生の量子収率(1光子あたり何分子の酸素が発生するか)としては最適条件で、0.106程度の値が得られていますので、系Iと系IIが均等に光を吸収すると仮定すると、1光子で系IIに流れる電子の数は、0.106 x 4 x 2 = 0.85 となり、Fv/Fmの実測値と一致します。
3.クロロフィル蛍光のスペクトル
1)室温での蛍光スペクトル
光合成系のクロロフィルが出す蛍光は、ある一定の波長分布(スペクトル)を持っています。希薄なチラコイド膜懸濁液の蛍光を室温で測ると、685 nmに鋭い発光極大が、740 nm付近にブロードな肩がみられます。ある色素から発光した蛍光は、色素の濃度が高い場合、別の色素にもう一度吸収されてしまうことがあります。この場合、色素の蛍光波長が吸収波長と重なっている部分で吸収が大きくなるので、蛍光のスペクトルは、本来のスペクトルとは形が違って、ピークが長波長にずれてしまいます。これを再吸収効果といいます。生葉などで測定すると再吸収効果と散乱のためにクロロフィルが大きな吸収を持つ685 nmのピークは相対的に大きく減少します。これらの蛍光はほとんど光化学系IIに由来し、光化学系Iの寄与は720 nmで5%、685 nmで1−2%です。系Iでも系IIと同様に光エネルギーの吸収速度と電荷分離速度を比べると、電荷分離速度が律速しているので、電荷分離ができる状態かどうかで蛍光強度に差があっても不思議ではありませんが、実際には系Iの電子受容体が還元されても蛍光収率の増大にほとんど寄与しません。これは光化学系Iの反応中心の酸化型P-700+が系IIのP-680+に比べて非常に安定で、しかも酸化状態でも励起エネルギーを受け取って熱に変えることができるためと考えられます。
2)低温での蛍光スペクトル
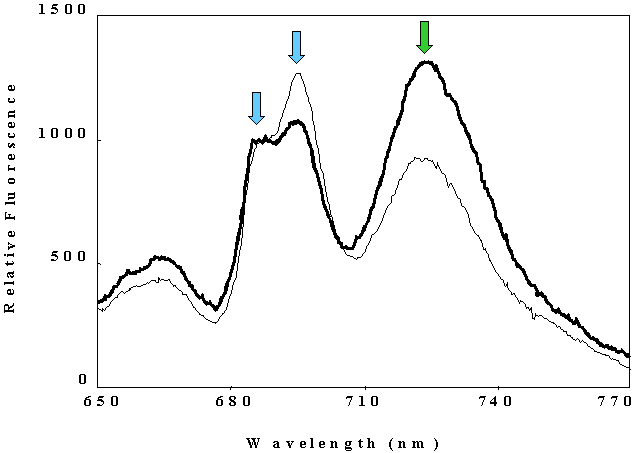 低温では蛍光スペクトルの形は大きく変化し、遠赤領域の系Iの蛍光が非常に強くなります。液体窒素温度(77K)における高等植物の蛍光スペクトルでは、系IIのCP43に由来するF685、同じく系IIのCP47に由来するF695、系I複合体に由来するF735が観察できます(右図)。LHCIが失われた標品では、系Iのコアに由来するF720が見られます。4Kまで冷却すると、LHCIIから発光するF680があらわれます。液体窒素温度でのF685またはF695とF735の強度比は相対的な系I/系IIの量比を反映するため、簡便な光化学系量比の測定法としてよく用いられます。ただし、前述のように、再吸収効果のため、スペクトルの形はクロロフィル濃度によって大きく影響を受けるため、クロロフィル濃度が異なる試料の間での比較はできません。また、生葉での測定とチラコイド膜での測定を比較することもできません。
低温では蛍光スペクトルの形は大きく変化し、遠赤領域の系Iの蛍光が非常に強くなります。液体窒素温度(77K)における高等植物の蛍光スペクトルでは、系IIのCP43に由来するF685、同じく系IIのCP47に由来するF695、系I複合体に由来するF735が観察できます(右図)。LHCIが失われた標品では、系Iのコアに由来するF720が見られます。4Kまで冷却すると、LHCIIから発光するF680があらわれます。液体窒素温度でのF685またはF695とF735の強度比は相対的な系I/系IIの量比を反映するため、簡便な光化学系量比の測定法としてよく用いられます。ただし、前述のように、再吸収効果のため、スペクトルの形はクロロフィル濃度によって大きく影響を受けるため、クロロフィル濃度が異なる試料の間での比較はできません。また、生葉での測定とチラコイド膜での測定を比較することもできません。
シアノバクテリアでは、通常、光化学系IIのアンテナとして働くフィコビリゾームは、フィコビリゾーム励起の光の下で、もしくは強光下で、光化学系Iにもエネルギーを渡します。このようなエネルギー分配の切り替え(ステート変化)がある場合には、光化学系の量比自体は変わらなくとも、エネルギーをより受け取るようになった光化学系からの蛍光発光は大きくなります。従って、ステート変化を起こす前後で、液体窒素温度での蛍光スペクトルを測定すれば、どの程度のステート変化が起こっているかを見積もることができます。図の太線と細線はステート変化の前後でシアノバクテリアの細胞の蛍光スペクトルを測定したもので、系IIのピークと系Iのピークの高さの比が変化していることがわかります。
液体窒素温度でも、F695のFv/Fmは0.8と、室温での値とよく似た値を与えます。FoからFmへの変化は室温でと同様に光化学系IIの受容体であるQAの還元を反映すると考えられますが、還元型QAの再酸化速度は非常に遅くなります。
4.蛍光の誘導期現象
1)誘導期現象の概略
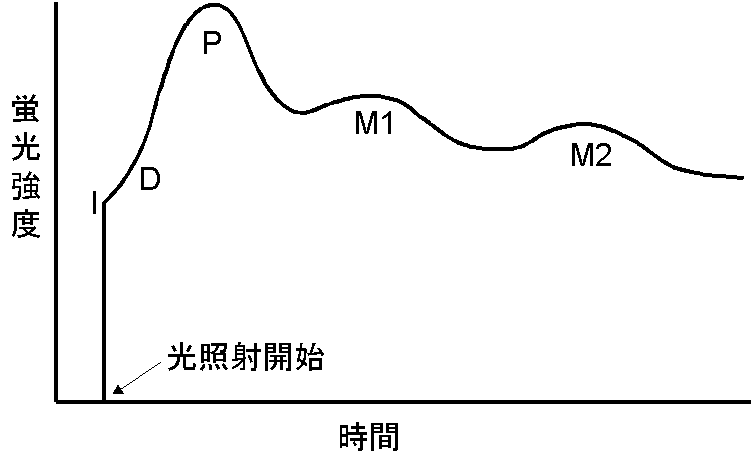 Muller は1874年に、暗所に置いた光合成をする細胞に一定光強度の連続光を照射するとその蛍光の収率が右図のように複雑に変化することを観察しました。この、蛍光収率(強度)の時間変化を蛍光の誘導期現象といいます。後にこの現象を定量的に研究した
Kautsky にちなんで Kautsky Effect とも呼ばれるこの変化は、1950年頃までは光合成研究の数少ない手段であったために、そのメカニズムの解明に多大な努力が払われましたが、その複雑な機構のため、ある程度理解されるようになったのは光合成の電子伝達成分がある程度分かってからでした。
Muller は1874年に、暗所に置いた光合成をする細胞に一定光強度の連続光を照射するとその蛍光の収率が右図のように複雑に変化することを観察しました。この、蛍光収率(強度)の時間変化を蛍光の誘導期現象といいます。後にこの現象を定量的に研究した
Kautsky にちなんで Kautsky Effect とも呼ばれるこの変化は、1950年頃までは光合成研究の数少ない手段であったために、そのメカニズムの解明に多大な努力が払われましたが、その複雑な機構のため、ある程度理解されるようになったのは光合成の電子伝達成分がある程度分かってからでした。
十分に暗所においた高等植物の光合成系においては、QAは通常完全に酸化状態にあります。ここから定常光の照射を開始すると、QAの還元などの変化にともなって蛍光強度はFoから実験条件や材料によって異なる複雑な過程を経て定常状態へと変化します。この過程における蛍光強度変化は、QAの酸化還元状態(つまり式3のkPの影響)および吸収した光エネルギーを熱として放散する能力(式3のkDの影響)によって主に決まります。しかし、QAの酸化還元状態だけでも、i)系II同士の励起エネルギー移動、ii)系IIの不均一性、iii)プラストキノンプールの大きさ、iv)系I以降の電子伝達速度(FNR,炭酸固定系を含む)、v)酸化された系IIへの電子供与などによって、影響を受けます。典型的な蛍光変化では、FoからFIへまず収率が増大し、次に収率の増加速度が減少する時期(FD)を経て次のピーク(FP)に達します。 QAが完全に還元され、熱放散の能力が最低の時には、FPはFmに一致しますが、そうでないとFmより低くなります。
2)DCMU存在下での蛍光誘導と系IIの不均一性
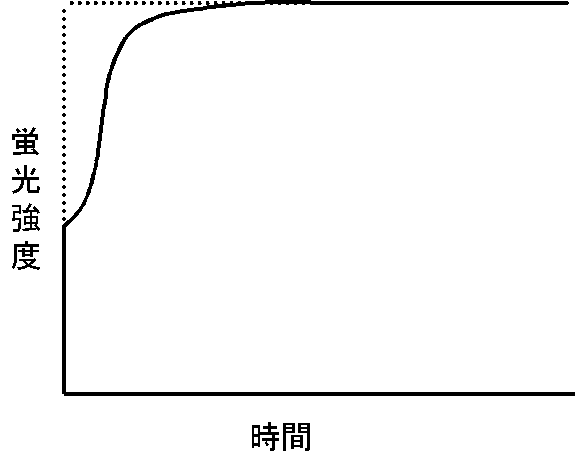 光化学系IIの電子伝達阻害剤であるDCMUを加えて蛍光の誘導期現象を測定すると、QAからQBへの電子伝達が阻害されるため、QAの還元が促進され、蛍光の最大レベル(Fm)への上昇も非常に速くなります(右図)。ただし、この場合にはQAの暗所での酸化が不完全になりがちなため蛍光の初期レベル(Fo)の若干の上昇がみられます。またプラストキノンの還元も不完全になり、酸化型のプラストキノンは蛍光の消光剤(蛍光の収率を下げる物質)として働くため、Fmレベルは若干低下します。光照射直後の蛍光増大速度が小さく、曲線がシグモイドになっているのは、一部の反応中心で反応中心間のエネルギーのやりとりがあり、closeな反応中心が受け取ったエネルギーがopenな反応中心に与えられることがあるためです。
光化学系IIの電子伝達阻害剤であるDCMUを加えて蛍光の誘導期現象を測定すると、QAからQBへの電子伝達が阻害されるため、QAの還元が促進され、蛍光の最大レベル(Fm)への上昇も非常に速くなります(右図)。ただし、この場合にはQAの暗所での酸化が不完全になりがちなため蛍光の初期レベル(Fo)の若干の上昇がみられます。またプラストキノンの還元も不完全になり、酸化型のプラストキノンは蛍光の消光剤(蛍光の収率を下げる物質)として働くため、Fmレベルは若干低下します。光照射直後の蛍光増大速度が小さく、曲線がシグモイドになっているのは、一部の反応中心で反応中心間のエネルギーのやりとりがあり、closeな反応中心が受け取ったエネルギーがopenな反応中心に与えられることがあるためです。
DCMUを加えて蛍光の誘導期現象を見た場合、上記のようなFoレベルとFmレベルの若干の変化を無視すれば、ある時間における蛍光の収率変化の曲線の上側の面積(図の実線と点線の間の面積)は、その時間における還元されたQAの割合に比例します。この面積の時間変化(=速度)は光の強さ、アンテナの大きさ、光化学反応の量子収率に比例します。またある光強度での面積の最大値AmaxはQA還元活性のある反応中心量の目安となります。
Melis と Homann はこの面積の時間変化を片対数プロットすると2つの成分αとβに分かれることを見い出しました。このうちαの成分の時間変化は指数関数にはのらず、グラナに存在する光化学系II(PSIIα)に由来し、βの成分はストロマチラコイドに存在する光化学系II(PSIIβ)に由来するとされます。つまり、蛍光の2つの成分は、光化学系IIの不均一性に由来すると考えられています。βの成分の時間変化は完全に指数関数にのり、反応中心間での励起エネルギーのやりとりがないことが示唆されます。Amaxのうち20−35%がこのβで説明されます。このQA還元の2相性は、250-350 nm領域の吸収変化によっても確認されました。
β成分のα成分より2−3倍遅い光化学反応は、当初、低下した量子収率に由来するとされました。その後、PSIIβのアンテナサイズ(正確には光断面積)がPSIIαより小さいことがわかりました。ホウレンソウの葉緑体では、PSIIαのアンテナサイズは250±40Chl、PSIIβのアンテナサイズは120±20Chlと見積もられました。同様の値がタバコ葉緑体でも得られ、またLHCIIがPSIIβでは欠けていることが示されました。さらに蛍光寿命の解析から、PSIIαとβでは電荷分離の速度とFv/Fmも異なっていることが示されました。一般的にはLHCIIのリン酸化によってPSIIαとβが相互に変換すると考えられています。高濃度のDCMUでPSIIβが観察されなくなるという報告から、系IIの不均一性は実験上のアーティファクトであるとする議論もありましたが、現在ではほぼ不均一性の存在自体は認められています。PSIIβでは反応中心にも違いがあり、QBが還元されないという報告もあります。
5.ポンプ&プローブ法による蛍光測定
1)ポンプ&プローブ法とは
蛍光の測定には、色素を励起するための測定光を当てる必要がありますが、従来の方法では、測定光に弱い連続光を使うため、測定光が光合成を駆動する励起光の役割も果たしています。これに対してポンプ&プローブ法では、この測定光に短く強いパルス光を用い、光合成の励起には別の光源(閃光またはパルス光のことが多い)を用います。通常の連続光による蛍光測定の場合は、測定光による励起効果が無視できませんが、このようなパルス光を用いた場合は、パルスの持続時間を短くすれば、パルス強度を強くしても、時間平均したときの光の強さは連続光に比べてきわめて小さくなります。従って、ポンプ&プローブ法では、(1)事実上励起効果を持たない(見かけ上暗所での)蛍光測定が可能になる、(2)測定パルス光の強度を上げることができるため感度のよい蛍光測定が可能になる、という2つの利点があります。このような利点を持つポンプ&プローブ法は、(1)測定光が励起作用を持つと測定が困難となる、閃光照射後の蛍光時間変化の追跡、(2)きわめて希薄な溶液(例えば海水そのもの)の蛍光測定などの感度を要求される測定、といった場合に用いられます。ちなみに、ポンプ&プローブの「ポンプ」とは、(1)の場合の最初の閃光照射のことで、「プローブ」はその後のパルス光による測定のことを指します。
2)ポンプ&プローブ法の実際
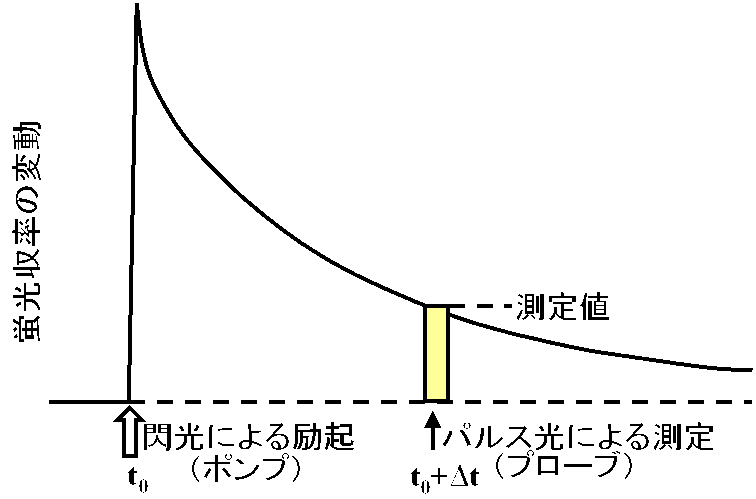 通常、ポンプ&プローブ法では、まず、光化学系IIを還元する閃光を照射します(右図)。この閃光によりQAはまず還元されて次いで再酸化されるという時間変化を示し、それによって蛍光の収率変化が引き起こされます。この際、最初の閃光照射(t0)からある一定時間後(t0+Dt)に測定パルス光を照射して蛍光をモニターします。このDtを変化させて繰り返し測定を行うことにより、蛍光の時間変化、つまりQAの酸化還元状態の時間変化を知ることができます。閃光照射後の蛍光の立ち上がり(QAの還元)速度は、光化学系IIのアンテナサイズに依存しますから、この立ち上がり速度からアンテナサイズに関する情報を得ることができます。また、QAの再酸化は、最初にQBへの電子伝達によって起こりますから、蛍光の減衰の初期速度を見ることによってQAからQBへの電子伝達速度を見積もることができます。特に後者のような情報は、原理的に定常光による蛍光測定では難しく、ポンプ&プローブ法の利点がもっとも良くいかされる測定例です。
測定パルスの励起効果を最低限に抑えるために、通常は1回の閃光後の測定で測定パルスは1回しか用いませんが、測定パルスの励起効果が無視できるときは、閃光照射後に測定パルスを複数回当てることにより、1回の測定のみで時間変化を求めることもできます。
通常、ポンプ&プローブ法では、まず、光化学系IIを還元する閃光を照射します(右図)。この閃光によりQAはまず還元されて次いで再酸化されるという時間変化を示し、それによって蛍光の収率変化が引き起こされます。この際、最初の閃光照射(t0)からある一定時間後(t0+Dt)に測定パルス光を照射して蛍光をモニターします。このDtを変化させて繰り返し測定を行うことにより、蛍光の時間変化、つまりQAの酸化還元状態の時間変化を知ることができます。閃光照射後の蛍光の立ち上がり(QAの還元)速度は、光化学系IIのアンテナサイズに依存しますから、この立ち上がり速度からアンテナサイズに関する情報を得ることができます。また、QAの再酸化は、最初にQBへの電子伝達によって起こりますから、蛍光の減衰の初期速度を見ることによってQAからQBへの電子伝達速度を見積もることができます。特に後者のような情報は、原理的に定常光による蛍光測定では難しく、ポンプ&プローブ法の利点がもっとも良くいかされる測定例です。
測定パルスの励起効果を最低限に抑えるために、通常は1回の閃光後の測定で測定パルスは1回しか用いませんが、測定パルスの励起効果が無視できるときは、閃光照射後に測定パルスを複数回当てることにより、1回の測定のみで時間変化を求めることもできます。
特殊な応用例として、蛍光カメラによる2次元蛍光画像時間分解解析が上げられます。蛍光をCCDカメラによって捉えて画像として解析する際に、測定パルスと同期させてシャッターを切ることにより、上記のパルス&プローブ的な効果を得ることができます。この場合、測定パルスとは別に、光合成を励起させるための定常光を当てることにより、蛍光の誘導期現象を2次元画像で捉えることが可能となります。
6.パルス変調による蛍光測定
1)パルス変調とは
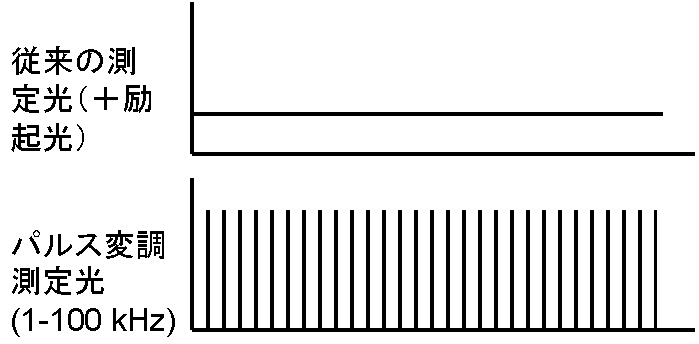 上にも述べましたが、弱い連続光を使う従来の蛍光測定では、測定光が励起光の役割も兼ねていました(右図、上)。蛍光測定におけるパルス変調とは、この測定光を、短い繰り返しパルス光で行い(右図、下)、試料からの発光のうち、測定パルス光の繰り返し周期と同じ蛍光成分だけを増幅して測定値とする技術(変調、英語ではmodulationといいます)を使います。この方法は、測定にパルス光を用いる点では上述のポンプ&プローブ測定と似ていますが、測定光であるパルス光が繰り返し照射され、一定の周波数(実際には1
kHz〜100 kHz)を持つため、パルス変調と呼ばれて区別されます。このような測定方法は、2つの大きな利点をもたらします。1つ目は、ポンプ&プローブ法と同様、測定パルス光の強度をある程度強くしても、パルスの幅を非常に短くすれば、時間平均したときの光の強さを連続光を使用したときに比べて、非常に小さく抑えることができる点です。つまり、適切なパルス強度と周波数を選べば、測定光による光合成系の励起は無視できるくらいに小さくなり、暗所での蛍光(Fo)を正確に測ることができます。さらに、ポンプ&プローブ法にはない、もう1つの利点をもこの方法は持ちます。変調という方法の特性上、繰り返し周期を持たない光による蛍光は増幅されないので、他の光が当たっているもとでの測定が可能である点です。つまり、必要であれば、直射日光が当たっている条件での蛍光の収率の変化を測ることもできます。同様に、外部からのノイズは(測定光の周波数と合わない限り)増幅されないので、非常に安定した感度での測定が可能で、生葉などでも充分な測定結果を得ることが可能です。
ただし、ポンプ&プローブ法に比べると測定パルスの照射回数が非常に多くなるため、励起効果を避けるためには1回のパルス強度は小さくせざるを得ず、一般的に絶対的な感度はポンプ&プローブ法よりも低くなります。
上にも述べましたが、弱い連続光を使う従来の蛍光測定では、測定光が励起光の役割も兼ねていました(右図、上)。蛍光測定におけるパルス変調とは、この測定光を、短い繰り返しパルス光で行い(右図、下)、試料からの発光のうち、測定パルス光の繰り返し周期と同じ蛍光成分だけを増幅して測定値とする技術(変調、英語ではmodulationといいます)を使います。この方法は、測定にパルス光を用いる点では上述のポンプ&プローブ測定と似ていますが、測定光であるパルス光が繰り返し照射され、一定の周波数(実際には1
kHz〜100 kHz)を持つため、パルス変調と呼ばれて区別されます。このような測定方法は、2つの大きな利点をもたらします。1つ目は、ポンプ&プローブ法と同様、測定パルス光の強度をある程度強くしても、パルスの幅を非常に短くすれば、時間平均したときの光の強さを連続光を使用したときに比べて、非常に小さく抑えることができる点です。つまり、適切なパルス強度と周波数を選べば、測定光による光合成系の励起は無視できるくらいに小さくなり、暗所での蛍光(Fo)を正確に測ることができます。さらに、ポンプ&プローブ法にはない、もう1つの利点をもこの方法は持ちます。変調という方法の特性上、繰り返し周期を持たない光による蛍光は増幅されないので、他の光が当たっているもとでの測定が可能である点です。つまり、必要であれば、直射日光が当たっている条件での蛍光の収率の変化を測ることもできます。同様に、外部からのノイズは(測定光の周波数と合わない限り)増幅されないので、非常に安定した感度での測定が可能で、生葉などでも充分な測定結果を得ることが可能です。
ただし、ポンプ&プローブ法に比べると測定パルスの照射回数が非常に多くなるため、励起効果を避けるためには1回のパルス強度は小さくせざるを得ず、一般的に絶対的な感度はポンプ&プローブ法よりも低くなります。
変調という技術はなじみがないように思われるかも知れませんが、実は多くの人が使っています。 ラジオで使うAM、FMというのは、それぞれAmplitude Modulation、Frequency Modulationの頭文字をとったものです。ラジオは、放送局によって決まった周波数のラジオ波で信号を送りますが、AMでは、音の強弱を波の振幅の大小に変換して送ります。聞く人は、ラジオで自分の聞きたい放送局を選ぶわけですが、この時やっているのが、そこらを飛び回っているさまざまな周波数のラジオ波のうち、特定の(自分の聞きたい放送局の)周波数の信号だけを増幅する、ということです。これが変調の本質です。ある周波数成分に信号を載せて送れば、それ以外にいくら信号が飛び交っていても、雑音が入ってきても、それらの信号が別の周波数成分である限り無視することができます。ちなみに、ここでは関係ありませんが、FMでは、音の強弱を周波数をどれだけ基本周波数からずらすかに変換して送ります。
2)飽和パルス光の意味
室温での蛍光は主に光化学系IIから発光し、系IIの蛍光収率は様々な要因によって左右されます。式3で示しましたように、蛍光の収率は、光合成にどれだけエネルギーが使われるか(kP)、および、どれだけのエネルギーが熱になるか(kD)、つまり初期電荷分離などの光化学反応的要因と光合成の制御などに関わる非光化学反応的要因の2つによって左右されます。蛍光の誘導期現象は、これらの2つの要因がからみあって影響を与えているため、その解析が難しかったと言えます。ここで、試料に、非常に短く、かつ光合成を飽和させるに充分な強さのパルス光を当てた場合の変化を考えてみましょう。パルス光が充分強ければ、そのパルスがあたっている時間内では、光化学系IIの電子受容体QAは一過的に完全還元されるはずです。一方、パルス光の持続時間が非常に短ければ、光合成系の制御状態に与える影響は非常に小さいと思われますから、光エネルギーが熱に変換される速度などは変化しないはずです。つまり、飽和パルス光があたっている間は、QAが還元されるので、反応中心がcloseになり、kPが0になります。 従って飽和パルス光があたっている時の蛍光収率は、光化学反応的要因がなくなり、非光化学反応的要因だけが影響を与えていることになります。逆に、飽和パルス光の照射によって変化した蛍光収率は、光化学反応的要因のみによって影響されることになります。このようにして、飽和パルス光を導入することによって、光化学反応的要因と非光化学反応的要因を分けて考えることができるようになります。この飽和パルス光は、測定パルス光とは全く別物ですので気をつけてください。
ここで、1つ注意しなくてはならないのは、飽和パルス光があたったときに蛍光シグナルが大きくなる現象は、色素がより多くの光を吸収すると蛍光がより強くなる現象とは全く別であるということです。上に述べたように、パルス変調蛍光法では、測定パルス光の周期にあった蛍光しか増幅されません。飽和パルス光は、測定パルス光の周期とは無関係に照射されますから、飽和パルス光によって励起された色素が出す蛍光は、本来全くシグナルとして現れるはずはありません。それでも、飽和パルス光によって蛍光シグナルが大きくなるのは、蛍光の収率が、反応中心がcloseになることによって大きくなるためです。パルス変調蛍光法では、励起光の強さをかえることはあっても、通常、測定パルス光の大きさは一定ですから、現れるシグナルは、蛍光の強度ではなく、収率であると考えた方がわかりやすいと思います。
3)Quenching Analysis
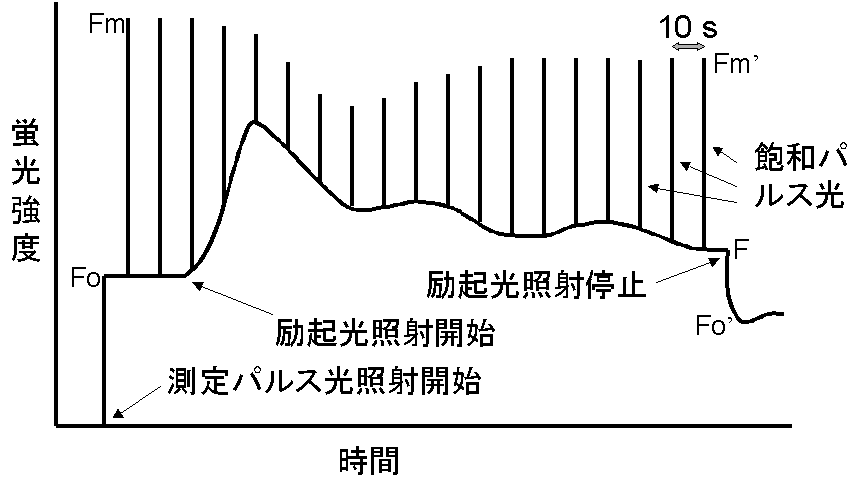 それでは、実際にどのように測定を行うかを見てみましょう。暗順応させた植物の葉を測定することを考えましょう。測定パルスの照射を開始すると蛍光はFoレベルまで上がります。前に述べましたように、測定パルス光の時間平均した強さは非常に弱いので、そのままでは蛍光はFoレベルのまま変化しません。そこへ、飽和パルス光を当てるとQAが一時的に還元されて蛍光は最大レベルのFmにまで上昇します。繰り返しになりますが、この蛍光レベルの上昇は、飽和パルスが励起した色素からの蛍光のせいではなく、飽和パルスによってQAが還元されて蛍光の収率が上がったことによる間接的な影響を見ているのです。飽和パルス光の周期は図の場合、10秒間隔にしています。次に励起光の照射を開始します。これは連続光なので、やはり励起光による直接の蛍光は観察されず、励起光により蛍光の収率が変化した間接的な結果として蛍光強度の変化が見られます。
蛍光レベルFは光化学消光と非光化学消光の2つの要因により変化しながら最終的に一定の値に落ち着きます。一方、飽和パルス光があたったときは、QAは完全に還元されますから、蛍光強度Fm’は非光化学消光の影響だけを受けることになります。つまり、Fm’の値をつないだ線の変化は、非光化学消光の変化をしめしています。図は、わかりやすくするために変化を大きく書いていますが、実際に、図のようなFの変化を示す励起光の強さでは、Fm’は余り変化しません。励起光を停止すると、蛍光は減少しますが、その時の蛍光の最小レベルFo’は最初のFoレベルより小さくなる場合があります。これは、励起光停止後、QAの再酸化は速やかに起こるのに対し、非光化学消光の解消は遅いため、非光化学消光により蛍光強度がFoレベルよりもさらに減少することによります。この際、QAの再酸化が迅速に起こらないと、Fo’レベルがきちんと求まらないので、光化学系Iに選択的に吸収される700
nm以上の光を当ててQAの速い再酸化を保証する場合があります。
それでは、実際にどのように測定を行うかを見てみましょう。暗順応させた植物の葉を測定することを考えましょう。測定パルスの照射を開始すると蛍光はFoレベルまで上がります。前に述べましたように、測定パルス光の時間平均した強さは非常に弱いので、そのままでは蛍光はFoレベルのまま変化しません。そこへ、飽和パルス光を当てるとQAが一時的に還元されて蛍光は最大レベルのFmにまで上昇します。繰り返しになりますが、この蛍光レベルの上昇は、飽和パルスが励起した色素からの蛍光のせいではなく、飽和パルスによってQAが還元されて蛍光の収率が上がったことによる間接的な影響を見ているのです。飽和パルス光の周期は図の場合、10秒間隔にしています。次に励起光の照射を開始します。これは連続光なので、やはり励起光による直接の蛍光は観察されず、励起光により蛍光の収率が変化した間接的な結果として蛍光強度の変化が見られます。
蛍光レベルFは光化学消光と非光化学消光の2つの要因により変化しながら最終的に一定の値に落ち着きます。一方、飽和パルス光があたったときは、QAは完全に還元されますから、蛍光強度Fm’は非光化学消光の影響だけを受けることになります。つまり、Fm’の値をつないだ線の変化は、非光化学消光の変化をしめしています。図は、わかりやすくするために変化を大きく書いていますが、実際に、図のようなFの変化を示す励起光の強さでは、Fm’は余り変化しません。励起光を停止すると、蛍光は減少しますが、その時の蛍光の最小レベルFo’は最初のFoレベルより小さくなる場合があります。これは、励起光停止後、QAの再酸化は速やかに起こるのに対し、非光化学消光の解消は遅いため、非光化学消光により蛍光強度がFoレベルよりもさらに減少することによります。この際、QAの再酸化が迅速に起こらないと、Fo’レベルがきちんと求まらないので、光化学系Iに選択的に吸収される700
nm以上の光を当ててQAの速い再酸化を保証する場合があります。
4)蛍光挙動の定量化 qNとqP
上述のように、蛍光の誘導期現象は、光化学反応的要因と非光化学反応的要因にわけて考えることができますから、それぞれを、定量化して解析することができれば便利です。光化学反応的要因と非光化学的要因は蛍光収率の変化として観察されますが、その絶対値だけでは、試料中のクロロフィル濃度などによって変化してしまうので、他の試料と比較できません。そこで、相対値の形をとることにします。
まず、非光化学的要因を考えてみましょう。蛍光の収率は、QAの酸化還元に依存して、値がFmからFoまで変化しますが、ある一定の励起光があたっていると、エネルギーを熱に変える収率が暗所における収率より高くなりますので、蛍光の値は、QAが完全に還元しているときは、FmからFm’へ、完全に酸化しているときは、FoからFo’へ低下します。また、FmとFoの差であるFvはFv’へと低下します。そこで、ある励起光照射によって、どれだけ蛍光収率が低下するかをqNという以下のようなパラメーターを使って表します。
qN=1−(Fm’−Fo’)/(Fm−Fo)=1−Fv’/Fv (式8)
このqNは非光化学消光(non-photochemical quenching)と呼ばれます。消光(quenching)とは蛍光収率が減少することで、この場合は、熱になる反応が大きいときに消光のパラメーターが大きくなるように、1から引き算をしています。暗所では、Fv’=FvですからqNは0になります(高等植物の場合、シアノバクテリアの場合は後述))。一方、消光が最大限になってFm’=Fo’(Fv’=0)となる時、qNは1になります。つまり、qNは熱になる反応の大きさに依存して、0から1の値を取ります。単に消光を定量化するだけなら1−Fm’/Fmでも1−Fo’/Foでもよいのですが、その場合、Fm’やFo’は0にはならないので、qNは1までは大きくなりません。Fvを使うと(実際に実現するかどうかは別として)理論的にはFv’が0になりうる(qNが1になりうる)ので、このようなパラメータにしているのでしょう。
ついで、光化学反応的要因を考えてみましょう。ある一定の励起光があたっているときは、非光化学消光によって蛍光の収率は変化し、QAが完全酸化および完全還元の時の値は、Fo’およびFm’になります。励起光のもとでの定常状態になったときの蛍光をFとすれば、この時のQAの酸化還元状態に応じてFはFo’とFm’の間の値を取るはずです。そこで、Fo’とFm’差を1としてFを標準化した値をqPとすると
qP=(Fm’−F)/(Fm’−Fo’) (式9)
となります。当然ですが、QAが完全に還元されたときはF=Fm’となりますから、qPは0に、完全に酸化されたときは、F=Fo’となりますから、qPは1となります。つまり、qPは、QAの酸化還元状態に応じて0から1の値を取るパラメーターで、光化学消光(photochemical quenching)と呼ばれます。この場合は、QAが酸化されているほど、エネルギーは光合成に使われて蛍光強度は小さくなりますから、消光を示すパラメーターは大きくなることになります。ただし、qPは厳密な理論的裏付けがあるわけではなく、経験的なパラメーターであり、QAの酸化還元状態と完全に直線関係があると保証されているわけではないことに注意してください。特に、非光化学消光が大きいときには、QAの酸化還元状態は、qPの値から予想されるより酸化的であることが多いようです。
このようにして、蛍光収率の時間変化を2つのパラメーター、光化学消光と非光化学消光で説明することにより、蛍光の誘導期現象のあいだに、どのような光合成系の変化が起こっているかを解析することができます。
5)蛍光パラメーターφII、ETRとその解釈
先に述べたように、Fv/Fmは光化学系IIの最大量子収率を示します。これは、暗所でQAが完全に酸化されているときの量子収率ですが、ある一定の励起光があたっているときにも、その状態で、系IIの中でQAが酸化されているものの量子収率をFv’/Fm’として表すことができます(当然ですが、QAが還元されている系IIは電子伝達ができないので、量子収率は0です)。さて、qPは上述のようにQAがどれだけ酸化されているかの割合ですから、Fv’/Fm’にqPをかければ、ある励起光下での実効量子収率が計算できるはずです。これをφIIと呼びます。
φII=qP・Fv’/Fm’
=(Fm’−F)/(Fm’−Fo’)・Fv’/Fm’
=(Fm’−F)/Fm’ (式10)
と変形できますから、系IIを通る電子伝達の実効量子収率は、Fm’とFの2つを測定すれば求まることになります。つまり、一定の励起光を当てておいて蛍光を測定し(F)、ついで、飽和パルスを当てて蛍光を測定すれば(Fm’)実効量子収率が求まります。実際にこの値は、別の方法で求めた電子伝達の量子収率と非常によい相関があることが確かめられています。
ここで、1つ注意しなくてはならないのは、このφIIは光化学系IIを通る電子伝達の量子収率ではありますが、その値は、光化学系II以外の要因によっても左右されることです。Fv’/Fm’は光化学系IIの状態によって決まりますが、qPは、いわば系IIの下流にどれだけ電子がたまっているかですから、b/f複合体であれ、光化学系Iであれ、系IIの下流に存在するコンポーネントが機能を失った場合は小さくなり、結果としてφIIも小さくなります。従って、もし、何らかの条件または処理で、電子伝達の量子収率φIIが減少していたら、その原因がqPにあるのか、Fv’/Fm’にあるのかを分けて考えてみれば、原因が光化学系IIの下流にあるのか、光化学系II自体にあるのかを見極めることができます。もし、Fv’/Fm’が低下していたときには、さらにFv/Fmが低下しているかどうかを見て、低下していれば光化学系IIの最大量子収率自体が低下していることになりますし、そうでなければ、励起光をつけたときに何らかの光化学系IIの量子収率を低下させるメカニズムが働いていることになります。後者であれば、熱になる反応の量子収率は高くなる場合が多いですから、通常、qNの上昇が観察されます。
以上をまとめると次のようになります。
φIIの減少 → 光合成電子伝達の何らかの異常(系IIに限らないことに注意)
┏qPが減少している場合 → 光化学系IIの下流に異常
┗Fv’/Fm’が減少している場合 → 光化学系II自体に異常
┏Fv/Fmが低下している場合 → 光化学系IIの最大量子収率が低下
┗qNが上昇している場合 → 光化学系IIの熱放散系の上昇
さて、ここで、φIIは電子伝達の量子収率ですから、これに吸収された光量子数をかければ、電子伝達の速度(ETRと略称)が求まるはずです。あたっている光量子数はすぐに測定できますが、吸収された光量子数の実測は簡単でないため、蛍光測定機器についているプログラムでは、照射光量子数に葉の吸収係数として0.84をかけて吸収された光量子数とします。実際の葉の吸収係数は植物種によっても葉によっても異なりますから、このようにして求められるETRは便宜的なものであることに注意しなければなりません。さらに、光化学系は光化学系Iと光化学系IIが直列に電子伝達を行いますから、吸収された光のうち、どれだけが光化学系IIに使われるかによって電子伝達速度の見積は違ってきます。一般的に、反応中心あたりのアンテナクロロフィルの数は、光化学系I、系IIともに200前後ですので、光化学系Iと光化学系IIはほぼ1:1に光を吸収すると考え、
ETR = φII x PAR x 0.84 x 0.5 (式11)
として計算している例が多いようです。ここでPARというのは光合成有効放射Photosynthetically active radiationの略で、クロロフィルが吸収できる範囲の波長の面積時間あたりの光量子数です(単位はmol quanta m-2 s-1)。
このようにして計算したETRは、必ずしも炭酸固定速度の実測値と一致しません。これは、上記の前提(葉の吸収係数や光化学系間のエネルギー分配比)が正確ではないことにも由来しますが、電子伝達によって作られた還元力のうちに炭酸固定に使われない部分があることも大きな要因です。炭酸固定系の鍵酵素であるRubiscoが、酸素をも基質として使うことによる光呼吸や、電子伝達により酸素が直接還元されて過剰な還元力が消去される浅田回路(water-water cycle)が働くときは、電子伝達速度が炭酸固定速度を上回ることになります。このような原因による差なのかどうかは、高二酸化炭素濃度、低酸素濃度の雰囲気で光呼吸や浅田回路を抑えてやれば、確かめることができます。
6)非光化学消光の原因
qPは、QAの酸化還元で説明が付きますから直感的に把握しやすいのですが、qNはどのような要因で変化するのでしょうか。非光化学消光qNは、強光下において光エネルギーを積極的に熱に変換することによる蛍光収率の低下を示します。具体的には、1)チラコイド膜のプロトン濃度勾配ができたときのキサントフィルサイクルなどによる過剰エネルギー消去、2)アンテナ複合体の反応中心間の移動(ステート変化)による蛍光収率の減少、3)光化学系IIの光阻害による蛍光収率の減少が主なもので、高等植物においては、プロトン濃度勾配の項が比較的大きいとされます。一方、後述のようにシアノバクテリアでは、ステート変化による部分がほとんどだとされます。プロトンの濃度勾配は、励起光を消すと、ATPaseを通したプロトンの流出で数十秒の時間スケールで解消しますし、ステート変化は10分程度で起こる現象です。また、光阻害の修復は通常数十分の時間スケールでおきますから、これらの3つの要因は、励起光を消した後のqNの回復(低下)を観察すれば区別することができます。
7)その他の蛍光パラメーター NPQとExcess
qNのかわりにNPQというパラメーターを非光化学消光の指標として用いる場合があります。qNは、その計算式の中に、Fo'を含むために、きちんと計算しようとすると励起光を一旦消して測定を行う必要があり、連続的な測定ができません。そこで、
NPQ = (Fm−Fm’)/Fm’ (式11)
というパラメーターが考案されました。これならば、最初に暗所でFmを測っておけば、あとは、連続的にFm’を測定していくだけで、パラメーターを計算できます。また、このパラメーターは、どれだけFmが励起光によって消光されてFm’になったかを、相対的に示すものですから、直感的にも理解しやすいと思います。このパラメーターは、なぜか、分母がFmではなくFm’になっているので、1以上の値を取ることもあります。それでは、qNとNPQの違いは何でしょうか。qNもNPQも厳密な理論的バックグラウンドがあるものではなく、経験的なものです。従って、実用的に使いやすい方を使えばよい、と考えて構いません。一般に、弱光領域では、qNの方が大きく変化しますので、弱光領域での非光化学消光の変化を敏感に捉えたいときはqNがお薦めです。一方、qNは強光領域では飽和してしまうので、強光領域も含めた広い領域の変化を捉えたいときはNPQの方がよいでしょう。 また、非光化学消光の原因となるキサントフィルの脱エポキシ化の程度や、非光化学消光を起こす物質の濃度、非光化学消光の反応速度などとの相関も、NPQの方が高いようです。キサントフィルサイクルや非光化学消光との定量的な関連づけを行いたいときはNPQの方がお薦めでしょう。
今まで議論してきた高等植物の非光化学消光は主にプロトン濃度勾配に伴うキサントフィルサイクルによって起こると考えてきました。キサントフィルサイクルは、キサントフィルの脱エポキシ化やLHCIIのプロトン化によってLHCII内で進行しますので、これらは、基本的に反応中心がopenであるかcloseであるかによらない、と考えることができます。一方、closeな反応中心で、キサントフィルサイクルによって熱にならなかったエネルギーは、トリプレットの生成など、反応中心に障害をもたらす可能性のある反応を経て、最終的に熱になると考えられます。このような考え方から、Excessというパラメーターが提唱されています。この考え方では、エネルギーを、反応中心に伝えられる前にLHCII内でキサントフィルサイクルで消去される部分と、反応中心に伝えられる部分に分け、この割合は、反応中心がcloseであるかopenであるかによらないとします。つまり、openな反応中心では反応中心にエネルギーが伝わる収率がFv'/Fm'ですが、これがcloseな反応中心でも成り立つとします。逆に言うと、1-Fv'/Fm'がLHCII内で安全に消去されたエネルギーとなります。 残ったFv'/Fm'が反応中心へと伝えられ、このうち反応中心がopenなものでは、電子伝達にエネルギーが使われるので、電子伝達の収率は、式10のようにqP・(Fv’/Fm’)となります。一方、残りのcloseな反応中心にいったエネルギーを
Excess = (1−qP)・Fv’/Fm’ (式12)
としてExcessとして定義します。Excessはストレスがかかっていない条件下では、日中の光強度が強いときでも小さいとされますが、ストレス条件下では大きくなり、光阻害などにつながると考えることができます。
8)シアノバクテリアにおける蛍光変化
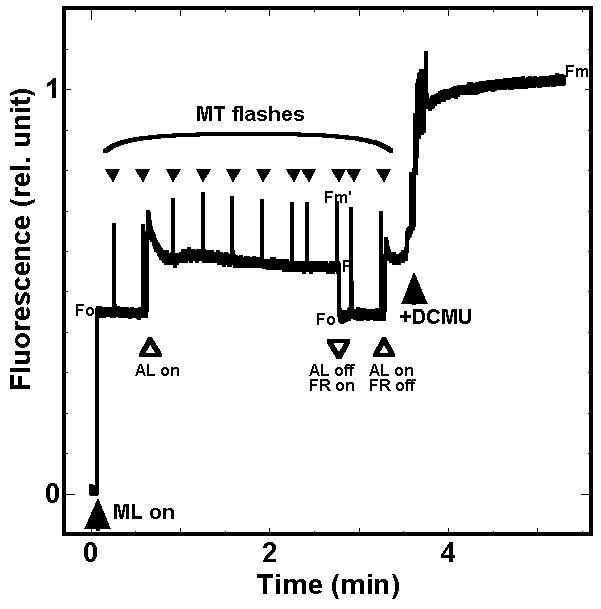 シアノバクテリアの場合は、状況が高等植物の場合と大きく異なります。シアノバクテリアの細胞で、蛍光測定を行うと、暗所で飽和パルスを当てても、そもそも蛍光の最大値が得られません(右図)。その後に励起光を当てたときの方が蛍光強度が高くなります。このまま強引にqNなどを計算しようとすると、マイナスの値になってしまいます。これは、暗所でもシアノバクテリアではqNが大きい(蛍光が小さい)ことによります。シアノバクテリアは原核生物で細胞内小器官を持ちません。しかも、光合成電子伝達系と呼吸電子伝達系が同じチラコイド膜上に共存し、プラストキノンプールとb/f複合体を共有しているため、暗所でも呼吸基質からの電子により、プラストキノンがかなり還元されています。このため暗所でもプラストキノンもしくはその近辺の還元をシグナルとしたステート変化が起こっており、大きなqNが観察されます。この点が、暗所ではプラストキノンプールが酸化されてqNが0になる高等植物とは全く異なります。
しかもシアノバクテリアのqNは、高等植物のようにプロトン濃度勾配による部分の寄与が大きくありません。プロトン濃度勾配を反映するATP/ADP比は、シアノバクテリアの場合はまったくqNと相関を持ちません。シアノバクテリアの場合は、フィコビリゾームから光化学系Iへのエネルギー分配(ステート変化)にともなう蛍光の消光が、qNの大部分を占めるとされています。
シアノバクテリアの場合は、状況が高等植物の場合と大きく異なります。シアノバクテリアの細胞で、蛍光測定を行うと、暗所で飽和パルスを当てても、そもそも蛍光の最大値が得られません(右図)。その後に励起光を当てたときの方が蛍光強度が高くなります。このまま強引にqNなどを計算しようとすると、マイナスの値になってしまいます。これは、暗所でもシアノバクテリアではqNが大きい(蛍光が小さい)ことによります。シアノバクテリアは原核生物で細胞内小器官を持ちません。しかも、光合成電子伝達系と呼吸電子伝達系が同じチラコイド膜上に共存し、プラストキノンプールとb/f複合体を共有しているため、暗所でも呼吸基質からの電子により、プラストキノンがかなり還元されています。このため暗所でもプラストキノンもしくはその近辺の還元をシグナルとしたステート変化が起こっており、大きなqNが観察されます。この点が、暗所ではプラストキノンプールが酸化されてqNが0になる高等植物とは全く異なります。
しかもシアノバクテリアのqNは、高等植物のようにプロトン濃度勾配による部分の寄与が大きくありません。プロトン濃度勾配を反映するATP/ADP比は、シアノバクテリアの場合はまったくqNと相関を持ちません。シアノバクテリアの場合は、フィコビリゾームから光化学系Iへのエネルギー分配(ステート変化)にともなう蛍光の消光が、qNの大部分を占めるとされています。
フィコビリゾームから光化学系Iへのエネルギー分配は、DCMUを添加したときには完全に抑えられ、このときには、系IIからの蛍光が相対的に一番大きくなり、qNは0となります。従って、DCMUを添加した後にはじめて蛍光の最大値Fmが得られることになります。シアノバクテリアの場合、通常の条件ではフィコビリゾームはかなり系Iにエネルギーを与えるようになっているため、系IIの蛍光は消光され、その結果、qNが大きい値をとります。エネルギーが系Iに移動するかは、主にプラストキノンプールがどの程度還元されているかによります。これは、プラストキノンプールが還元される条件、つまり、系IIからの電子が過剰な条件では、系Iへエネルギーをより多く分配するためのメカニズムであると考えられます。ただし、プラストキノンの酸化還元を表すqPとステート変化の指標となるqNの間には、必ずしも相関がない場合もあり、この理由はまだ解明されていません。
シアノバクテリアの場合、もう一点、測定上の問題となるのは、大きく速いqNの存在自体です。高等植物の場合、0.8秒程度の飽和パルス光の照射によってFmないしはFm’を得ることができますが、シアノバクテリアの場合は、この0.8秒の間にも非光化学消光がおこり、蛍光が減少してしまいます。従って、レコーダーなどのレスポンスの遅い記録機器で測定をしていると、蛍光を過小評価してしまいます。オシロスコープを使う、電気信号としてそのままパソコンへ取り込む、データ保持回路を使用する、などの対策が必要となります。
9)シアノバクテリアのqNと光環境
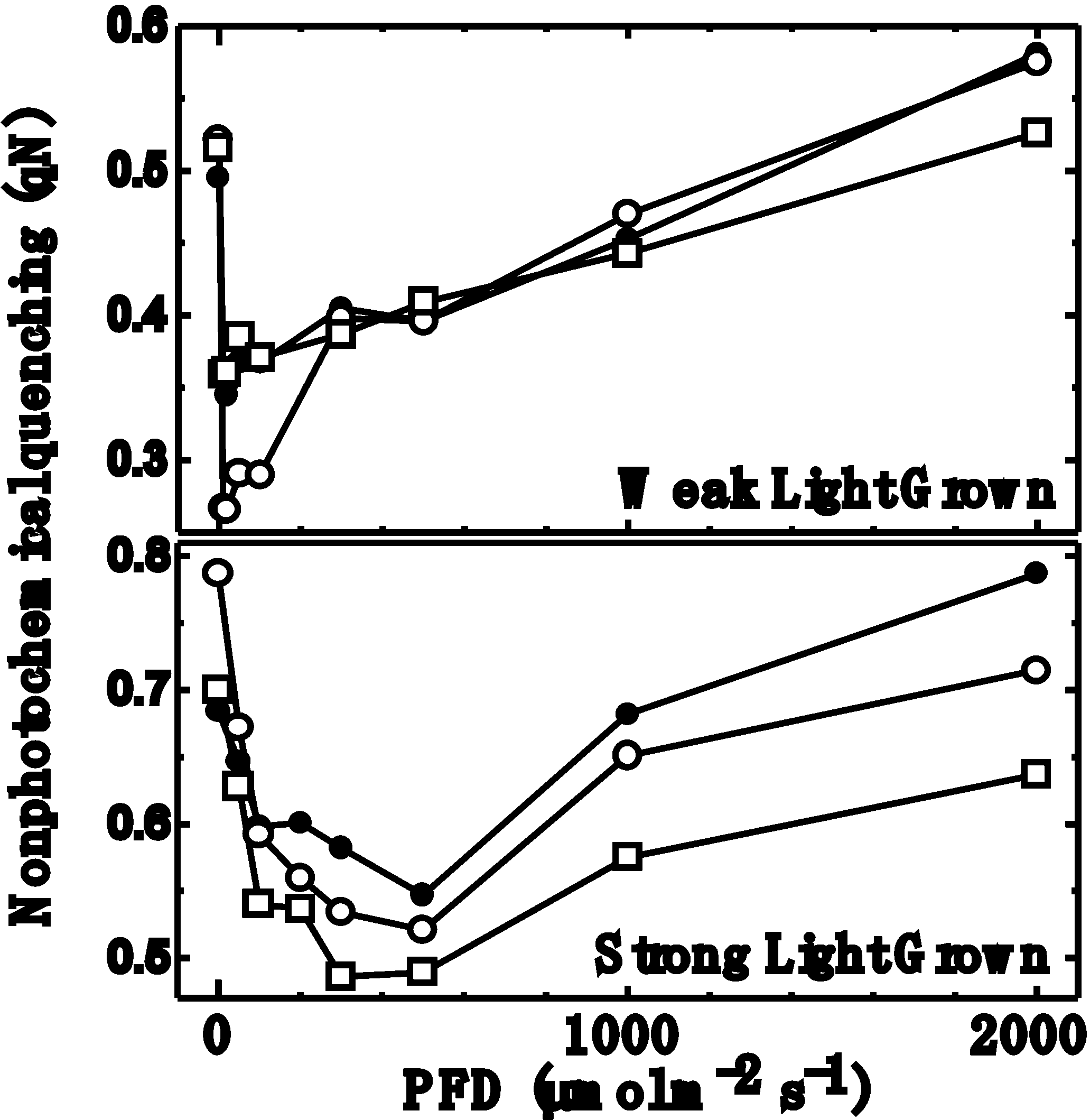 シアノバクテリアにおいてはqNの励起光強度依存性は、興味深い性質を持ちます。qNは、暗所では呼吸によるプラストキノンプールの還元のため、高い値となりますが、励起光を徐々に強くしていくと光合成の光化学系Iと系IIが働いて、そのバランスがとれるところまでプラストキノンが酸化され、qNは低下します(右図)。さらに励起光を強くしていくと、b/f複合体でのプラストキノンの酸化が律速段階となるため、プラストキノンの還元が起こり、qNは再び上昇します。このように、qNは励起光強度に対して下に凸の曲線を取りますが、qNが最小値となる光強度を、そのシアノバクテリアの生育光強度に対してプロットすると、非常によい相関が見られます。つまり、シアノバクテリアでは、生育光環境でもっともqNを小さくしており、言い換えるとエネルギーを無駄に熱に変える割合をもっとも小さくしている、といえます。
したがって、逆に、あるシアノバクテリアのqNの励起光強度依存性を測定し、その最小値を与える光強度を求めれば、そのシアノバクテリアが順化している光強度が求まることになります。野外などにおいて、あるシアノバクテリアがどのような光環境の中で生育しているかを推定することは通常困難が伴いますが、qNを使えば、光環境を見積もることが可能になります。
シアノバクテリアにおいてはqNの励起光強度依存性は、興味深い性質を持ちます。qNは、暗所では呼吸によるプラストキノンプールの還元のため、高い値となりますが、励起光を徐々に強くしていくと光合成の光化学系Iと系IIが働いて、そのバランスがとれるところまでプラストキノンが酸化され、qNは低下します(右図)。さらに励起光を強くしていくと、b/f複合体でのプラストキノンの酸化が律速段階となるため、プラストキノンの還元が起こり、qNは再び上昇します。このように、qNは励起光強度に対して下に凸の曲線を取りますが、qNが最小値となる光強度を、そのシアノバクテリアの生育光強度に対してプロットすると、非常によい相関が見られます。つまり、シアノバクテリアでは、生育光環境でもっともqNを小さくしており、言い換えるとエネルギーを無駄に熱に変える割合をもっとも小さくしている、といえます。
したがって、逆に、あるシアノバクテリアのqNの励起光強度依存性を測定し、その最小値を与える光強度を求めれば、そのシアノバクテリアが順化している光強度が求まることになります。野外などにおいて、あるシアノバクテリアがどのような光環境の中で生育しているかを推定することは通常困難が伴いますが、qNを使えば、光環境を見積もることが可能になります。
7.パルス変調による吸収測定
1)吸収測定の原理
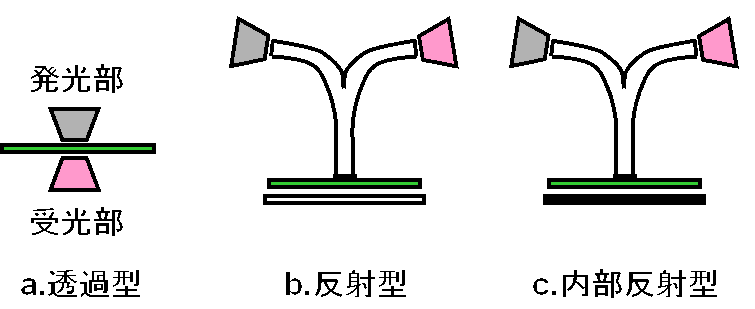 上記のパルス変調による蛍光測定では、当てる光の波長とシグナルとして受け取る光の波長をずらすことによって蛍光を測定していますが、当てる光の波長と受け取る光の波長を同じにすれば、その波長での吸収・反射・散乱などを測定することができます。通常の吸収測定とは違って、パルス変調により、ノイズが軽減されるので、葉の吸収の少ない赤外領域の光を使えば、生葉での吸収変化の測定が可能となります。一般の吸収測定でのように発光部と受光部の間に試料を入れて吸収を測定することも可能ですが(透過型、図a)、葉の場合は、海綿状組織などで光が散乱されるので、その散乱光をグラスファイバーを経て受光することにより、発光部と受光部を葉の同じ側においた状態でも、吸収を測定することができます(内部反射型、図c)。また、葉の反対側に光を反射するものをおいて測定することもできます(反射型、図b)。
上記のパルス変調による蛍光測定では、当てる光の波長とシグナルとして受け取る光の波長をずらすことによって蛍光を測定していますが、当てる光の波長と受け取る光の波長を同じにすれば、その波長での吸収・反射・散乱などを測定することができます。通常の吸収測定とは違って、パルス変調により、ノイズが軽減されるので、葉の吸収の少ない赤外領域の光を使えば、生葉での吸収変化の測定が可能となります。一般の吸収測定でのように発光部と受光部の間に試料を入れて吸収を測定することも可能ですが(透過型、図a)、葉の場合は、海綿状組織などで光が散乱されるので、その散乱光をグラスファイバーを経て受光することにより、発光部と受光部を葉の同じ側においた状態でも、吸収を測定することができます(内部反射型、図c)。また、葉の反対側に光を反射するものをおいて測定することもできます(反射型、図b)。
通常の分光器とは違って、パルス変調を利用した吸収測定では、、受光部で受け取った光の量がそのままシグナルとして出されます。つまりシグナルは吸収ではなく、光強度です。ところが、分光セルに入れた試料と違って、葉では、光がどこを通ったかなどについては、全くわかりません。例えば、上記の反射型では葉をいったん通り抜けた光が受光部に戻るので光路はかなり長くなりますが、内部反射型では、主に葉の細胞内間隙で反射された光が戻りますから、光路は比較的短くなります。従って、吸収の絶対測定には全く意味がありません。情報が得られるのは、吸収変化の測定だけです。
2)P-700の測定と吸収変化への変換
P-700は光化学系Iの反応中心クロロフィルで、酸化されると、700 nm付近に吸収減少を、750-850 nm付近にクロロフィルカチオンの生成に伴うブロードな吸収増加を示します。800 nm付近ではクロロフィルの吸収はほとんどないこと、酸化還元による吸収変化が知りたい情報であること、の2点から、P-700の測定は、パルス変調の測定に非常に適しています。実際の測定は、700 nm前後の近赤外光(遠赤光)を照射する前後で、820 nmの吸収を測定することにより、P-700の量を定量します。系Iが吸収する遠赤光の照射によってP-700が酸化されると820 nm付近の吸収は増加するので、受光部に入る光量は減少します。この光量の変化を吸収変化に換算するには以下のようにします。
まず、試料に入る前の光量をIo、試料を通過したあとの光量をI、試料が吸収変化起こしたあとの光量をI+ΔIとします。さて、ある関数y=f(x)において、yの小さな変化Δyは、xの小さな変化Δxとf(x)の微分(つまり、関数の傾き)であるf'(x)を用いて、
Δy = Δx ・f'(x) (式13)
と表すことができます。ただし、この式が成り立つのは、ΔxもしくはΔyが充分小さいときです。次に、吸収Aは透過率Tを用いて
A = log(T) (式14)
となります。そこで、小さな吸収変化ΔAは式13とlog(x)を微分すると1/xになることを考えると
ΔA = ΔT・(1/T) (式15)
となります。吸光度TはI/Ioですから、これを式15に代入すると
ΔA = (ΔI/Io)/(I/Io) = ΔI/I (式16)
となります。つまりP-700の酸化に伴う光量の変化量を、吸収変化を起こす前の光量で割れば、吸収変化量になることがわかります。 雑誌の論文でも、ΔIをそのまま吸収変化(ΔA)と混同している例がありますので、注意してください。 また、この式はあくまで、ΔIが充分小さいときにのみ成り立つことに注意してください。
3)系Iの実効量子収率
 光化学系IIのある光強度における実効量子収率(φII)は、その光強度における反応中心がオープンである割合(qP)とオープンな光化学系IIの量子収率(Fv’/Fm’)を掛け合わせることで
求めることができます(6.5参照)。同様な実効量子収率は光化学系Iについても定義できるはずです。反応中心がオープンな割合は、P-700に関しては、還元型P-700/(還元型P-700+酸化型P-700)で表すことができます。オープンな光化学系Iの量子収率を直接測定することはできませんが、一般に、光化学系Iの量子収率は条件によって変化しないとされていますので、もしそれが正しければ、実効量子収率はオープンな反応中心の割合に比例するはずです。このような考え方で、光化学系Iについてもその量子収率φIを定義する場合があります。
光化学系IIのある光強度における実効量子収率(φII)は、その光強度における反応中心がオープンである割合(qP)とオープンな光化学系IIの量子収率(Fv’/Fm’)を掛け合わせることで
求めることができます(6.5参照)。同様な実効量子収率は光化学系Iについても定義できるはずです。反応中心がオープンな割合は、P-700に関しては、還元型P-700/(還元型P-700+酸化型P-700)で表すことができます。オープンな光化学系Iの量子収率を直接測定することはできませんが、一般に、光化学系Iの量子収率は条件によって変化しないとされていますので、もしそれが正しければ、実効量子収率はオープンな反応中心の割合に比例するはずです。このような考え方で、光化学系Iについてもその量子収率φIを定義する場合があります。
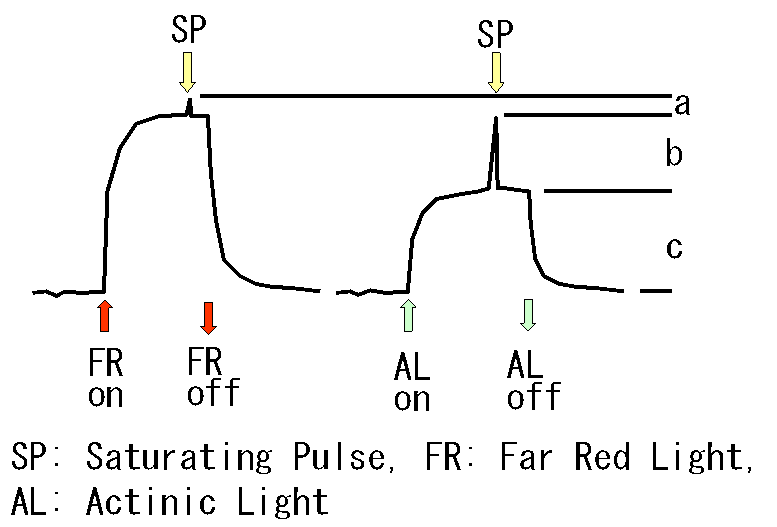
実際にP-700による吸収変化を測定すると、右の図のようになります。暗所ではP-700は還元状態と考えられます。ここに赤外光(FR)を当てるとP-700のほとんどが酸化され、残ったわずかな還元型のP-700も飽和パルス光(SP)を当てることにより酸化されます。従って、図のa+b+cがP-700の全量を示すと考えることができます。一方、一定強度の励起光(AL)を当てた場合、P-700は酸化型と還元型が平衡状態になります(図のcの高さ)。ここで、飽和光を当てるとほとんどのP-700が酸化されますが、一部(図のaの部分)は還元型で残ります。
この解釈として、ドイツのグループは系Iの電子受容体が励起光によって一部還元されているためにその一部では電荷分離が起こらず(もしくは電荷分離が起こっても電荷再結合(逆反応)が速く)P-700を完全に酸化することができない、と考えました。このような考え方にたてば、図のaの部分は、P-700は還元型であっても電荷分離できないので、オープンな光化学系Iの割合はb/(a+b+c)になり、このグループはこれをφIと定義しています。
ただし、aの部分に関しては別の解釈も可能です。一般に、飽和パルス光源の光強度の立ち上がりには時間がかかるため、飽和パルス光が本当の意味で飽和光になるまでには一定の時間がかかります。飽和パルス光源は当然光化学系IIも励起しますから、この時間内に、光化学系IIからの電子がP-700まで到達してしまうと、P-700を完全に酸化することは難しくなります。このことは飽和連続白色光を当てた場合にはP-700が一部還元されることからもわかります。赤外光を当てているときには、ほとんどのP-700があらかじめ酸化されていますから、飽和パルス光源によりP-700が完全酸化されますが、励起光照射時には、還元されているP-700が多いため、飽和パルス光がP-700を完全に酸化する前に光化学系IIからの電子がP-700を還元してしまい、図のaの部分についてはP-700を酸化しきれない、という解釈も成り立ちます。この場合は、単に技術的な問題のために図のaの部分を酸化できないだけなので、オープンな光化学系Iの割合は(a+b)/(a+b+c)となります。
実際には実験の条件によってもどちらの考え方が正しいかは異なるようです。特に飽和パルス光の特性が大きく影響を与えます。ドイツのグループのオリジナルな論文では飽和パルス光にメカニカルシャッターを組み合わせることにより光強度の立ち上がりを速くしているのでたぶん問題ないのですが、その後この方法を使った論文ではそのような配慮をしていないケースも多く、技術的な問題が大きく効いている可能性があります。図のaの部分の解釈として、上記の2つのケースのうちどちらが正しいかを見分けるには、暗所で飽和パルス光を当てたときにP-700が全量酸化されるかどうかを見ればよいかと思います。電子受容体の還元が図のaの部分の原因であれば、暗所では電子受容体は酸化されているはずなのでP-700は全量酸化されるはずですし、系IIからの電子が原因であれば、暗所ではもともとP-700がほとんど還元されているので、P-700は完全酸化されないはずです。いずれにせよ、このように定義されたφIは、実効量子収率そのものではなく、オープンな系Iの割合を示したものであることを注意する必要があります。
修正点1: 4.2の中で「QAの暗所での酸化が」は初出時「QAの暗所での還元が」と誤って記載されていました。(2004.7.29修正)