日立356型分光光度計によるP-700の定量
日立が以前出していた356型分光光度計は、その巨大な大きさが現代の実験室とは相いれませんが、極めて優秀な分光器でした。この356型分光光度計を用いて光化学系Iの反応中心クロロフィルであるP-700の測定を行う方法を以下に紹介します。P-700測定の一般論に関してはチラコイド膜における光化学系I(P-700)の定量をご覧ください。
以下では、チラコイド膜などの溶液試料で横から試料をあてられるように改造した日立356型分光器を用いてP-700を測定します。測定波長は通常700 nm付近なので、励起光照射時に出るクロロフィル蛍光が測定を妨害する可能性があり、試料室と光電子増倍管の距離を長く取れる分光器が適しています。356型分光光度計は、試料室の位置を光電子増倍管から離れたところにも設置できるという点で、P-700の測定に極めて適した分光器でした。一方で、435 nm付近で測定すれば、蛍光の妨害はなくなりますが、この波長領域では、P-700以外にも吸収変化を示すものがある可能性があるため、チラコイド膜などの測定の場合は、好まれません。
準備するもの
- 2波長2光線分光光度計(Model 356, Hitachi)
- ペンレコーダー(Model 056, Hitachi)
- セル(10 × 5 mm 4面透明の石英セルを使用している:黒のビニールテープで右の図のようにサンプルのない部分をマスクして使用する)
- 光源(Nikon Transformerと書いてある可変電圧ランプ電源にNikon 45808というランプを接続して用いる)
- 両開クランプ(ランプ固定用)
- H形スタンド(テラオカ:ランプ固定用で356用と書いてある)
- ラボジャッキ(水フィルターおよび光源の高さを調節するためのもの)
- 微量高速遠心機(Hitachi Himac CF15R、あらかじめ4℃に冷やしておく)
- サンプル調製用氷容器
使用する光学フィルター類
- 熱線カット用の水フィルター:励起光を通すためのもの。培養ビンに赤外線カットフィルターHR-50(Toshiba)が張り付けてある。

- 励起光用フィルター:サンプルフォルダーの窓にバンドパスフィルターCS 4-96(Corning Glass)張り付けてある。後述する蛍光の寄与が大きい場合には、V-42フィルターをさらに加えるとよい。
- 光電子増倍管の保護フィルター:カットオフフィルターR-69(Toshiba)と700 nm干渉フィルター(Toshiba)が光電子増倍管に取り付けてある。交換する際には光電子増倍管の取り扱いに注意すること。幅広く透過するR-69の方を光源側に、より透過光範囲の狭い干渉フィルターを光電子増倍管側にセットする。
試薬
- 1% β-dodecyl maltoside (DM):4℃保存、DWで調製。
- 50 mM Tris/HCl buffer (pH 7.5):室温保存だが、使用前に取り分けて氷上で冷やしておくようにする。
- 0.5 M sodium ascorbate:-20℃保存。DWで調製。
- 20 mM N,N,N'N'-tetramethyl-p-phenylenediamine (TMPD):常温で酸化して青く変色するので、200 mMのストック(-20℃保存)から使用時に調製する。二塩酸塩を用いてDWで調製(二塩酸塩でないものを買った場合はそのままでは水に溶けづらいので、塩酸を加えて溶かす)。
- 2 mM methyl viologen (MV):室温保存。DWで調製。
- 1 mM 3-(3,4-dichlorophenyl)-1,1-dimethylurea (DCMU):-20℃保存、100% EtOHで調製。
測定試料の準備
- 1.5 mlのチューブに13.5 μg Chlorophyll (15 nmol)を含むチラコイド膜サンプルを加える。(以下、作業は氷上で行なう)
- 1% DMを20 μl加え、軽くボルテックスする(この段階で、一時的にDMが高濃度になることでチラコイド膜が可溶化する)。
- 50 mM Tris/HCl buffer (pH 7.5) を他の成分(1, 2, 4-7)を全て差し引いた分量、すなわち1000-59-(1.で加えたチラコイド膜サンプル量)(μl)加える。
- 0.5 M sodium ascorbateを20 μl加える。
- 20 mMのTMPDを4 μl加える。
- 2 mMのMVを5 μl加える。
- 1 mMのDCMUを10 μl加える(最後に加えるのは他へのコンタミを防ぐため)。
- 軽くボルテックスし、4℃, 15000 rpmで10 min遠心し、可溶化しないデンプンなどを沈殿させる。
- 氷容器にチューブを移しての蓋を閉め(遮光)、分光器の前に移動する。
通常の方法で単離した高等植物のチラコイド膜は、ある程度のプラストシアニンがチラコイド膜内腔に閉じこめられたままになっているので、DCMUを加えないと系IIからの電子伝達が早すぎて光を当ててもP-700を十分に酸化できない。シアノバクテリアののチラコイド膜は、単離の際にチトクロームc6をほとんど失っているため、DCMUを加えなくても系IIからの電子がP-700を還元することはなく、そのままで測定可能。また、シアノバクテリアの場合は系Iの相対量が多くアンテナクロロフィルは少ないため、測定に必要なクロロフィル量は3-10 nmolで十分である。この場合、TMPDの量も調節する必要がある。調節の仕方については最後の「サンプルの種類が変わった際に調整すること」を参照。
分光器(日立356)のチェックおよび光源準備
- 必要に応じ第二資料室(右側の資料室)奥の採光窓をねじ蓋で閉じる。
- 必要に応じ、光電子増倍管を外し(光に当てないようにする)、保護フィルターを取り付ける(R-69および赤色干渉フィルター)。
- ステージを1セルタイプのものに交換する。
- マスクを向きに気をつけてはめてから、マスクを抑えるように光電子増倍管を固定する(※光電子増倍管の白線と、止め金具の白線を重ね合わせる)。
- サンプル室内にあるSPRIT/DUALの切り替えをDUAL(サンプル光とリファレンス光が光電子増倍管上の同じ面に入る)にする(※光電子増倍管の感面の違いによる差をなくすため)。
- SCANNINGのSELECTをλ1=λ2にして、λ2の波長設定窓を見ながら測定波長(700
nm)に合わせる(一度BACKで長波長側にしてから微調整する)。

- SLITを4 nm (切り取れる波長幅)、1 mm (実際のモノクロメータースリットの幅)にセットする。
- HIGH VOLTAGEをAUTOにセットする。
- REFERENCE SIGNALはλ1にセットする。
- RESPONSE(時間応答)をF(fast)にセットする(Sの方がノイズは減るが、P700の吸収変化は高速の変化なのでFでみる)。

- RANGEをENERGY(高電圧がかかっていない状態)にする(電源を入れる時や測定をしていない時は常にここに合わせる)。
- 励起光のランプ電源を入れ、電圧をあげた時ランプがきちんとつくかどうかチェックする。また、ランプの高さや向きを調整し、サンプルフォルダー全体に光がきちんとあたっているかを紙などで確認する(CS 4-96を透過したサンプルフォルダー位置における光量子束密度は40 μmol m-2s-1であった)。
分光器の動作チェック
- 356のRANGEをENERGYにしている状態でPOWERをONにする(本体全面の赤いボタンを押す)。
- レコーダーのRANGEを10 mV 、モードをSERVOに合わせる。
- RANGEをT=100%にする(このときHIGH VOLTAGEのゲージをみて200 V前後になっていることを確認する)。※もし0になっていたら、蓋がきちんと閉じてないため安全装置が働いていないかチェックする。もし高すぎたら、光電子増倍管の接触不良、もしくはフィルターの組み合わせがおかしい、のいずれかを疑うこと。
- SHUTTERをλ2にセットし(サンプル光のシャッターが閉じる)、レコーダーの0を0点調節つまみにより合わせる。
- SHUTTERをopenにセットし、レコーダーの100をあわせる(最初は両方のoptical attenuator(スリットから出た光の量を調節する絞り)が全開の状態にして調整を始める。レコーダーの針が100を超えた時はλ2のoptical attenuatorを絞っていき、サンプル光量を減らすことで調整し、100に満たない時はλ1のoptical attenuatorを絞って調節する。ただし、 attenuatorのネジが外れやすいので無理に回さないこと。)
- RANGEをA=1.0に変えてきちんとレコーダーのペンが0を示すことを確認する。
- 動作チェックが終わったら、RANGEをENERGYに戻しておく。両方のoptical attenuatorも全開の状態に戻す。
P-700光酸化量測定
- サンプルをセルにデカントで注いだあと、第一資料室(左側)の蓋を開け一番手前のフォルダーに光路長が1 cmになる向きにセルをセットする(この時次の測定サンプルを氷から出しておくとセルの結露を防ぐことができる)。
- 分光器のRANGEをΔA0.01(レコーダーのフルスケールが0.01になる)にセットする。
- ペンレコーダーのスイッチをSERVOにし、λ1(reference)側のoptical attenuatorを調節して、ペンレコーダーの可動範囲にベースラインがくるようにする。ペンを下ろす。
- 手動シャッター(銀紙で包まれた厚紙)をランプと水フィルターの間に挟み、その状態で励起光をONにする。
- レコーダーをCHART(60 mm/minのスピードが適当)にする。
- ベースラインが落ち着いた適当なところで手動シャッターを素早く持ち上げ、サンプルに光を照射し、P700を光酸化させる(レコーダーが20-30目盛りほど動く)。
- チャート紙の線から線を目安に、適当な所で手動シャッターを下ろす。
- 6-7を3回ほど繰り返す。
- 測定が終了したら、レコーダーをAMPにして止め、ペンを持ち上げる。
- 励起光ランプ電源の電圧を0に下げてから、スイッチをOFFにする。
- RANGEをENERGYに戻してから、サンプル室の蓋を開けてセルを取り出す。
- サンプルをセルからデカントで回収し、セルはキムワイプの上に逆さまに立てて余分な水分を吸い取る。
- 次の次のサンプルを常温においてから、あらかじめ常温においてあるサンプルで測定を続ける。
- 全測定が終了したらRANGEがENERGYになっていることを確認してPOWERをOFFにする(もう一度赤いボタンを押せば良い)。
データ解析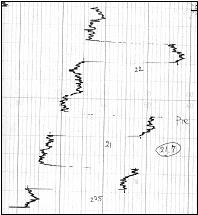
酸化状態のP-700(明)と還元状態のP-700(暗)の701 nmにおける吸光度の差が、P-700の光酸化量に相当する(※通常P-700の光酸化速度は非常に速いが、暗還元速度は遅いので光酸化量の最大値を得るには、光照射直後の吸光度変化を用いる)。データにノイズがあるので、光を照射する直前のノイズの中点から、光を照射した直後のノイズの中点までを吸光度変化とする。このプロトコルの条件で測定したのは、15 μM Chlorophyllのサンプル中のP-700(ミリモル分子吸光係数 = 63 mM-1cm-1、末尾の参考文献参照)の吸光度であるから、レンジ(ΔA=0.01)を考慮すると、サンプルに含まれるP-700の濃度(mM)およびP-700のアンテナサイズChl/P-700はそれぞれ以下のように計算できる。
P-700 (mM) = 0.01×目盛り数/100/63
Chl/P-700 = 15 [μM]/(1000×P-700 [mM])
右図の例(キュウリチラコイド膜)の場合、P-700 (mM) = 3.57×10-5、Chl/P-700 = 433 と計算できる。
サンプルの種類が変わった際に調整すること
1.スリット幅
P700の吸収帯は同時にクロロフィル蛍光の発光帯でもあるため、蛍光の寄与があると吸光度は見かけ上減少してしまう。そのため、スリットの幅を大きくし入射光を増加することにより相対的に蛍光によるノイズを減らすことができる(※直線的に進むの測定光に対し、蛍光はサンプルから全方向に放射状に発せられるため、サンプルフォルダーと光電子増倍管の距離を遠ざけることにより蛍光による妨害を本測定法では減らしているが、それだけでは十分ではない)。逆に、スリットを広げすぎると、特に吸収帯の幅が狭い場合、吸収変化をしていない波長領域をも含めて平均することになり、シグナルは小さくなる。
2.TMPD(P-700への電子供与体:P700の還元を促進する)の量
スリットの幅を大きくした場合、当然、入射光(測定光)が強くなる。測定光が強すぎると、励起光を照射する前にP-700が酸化されてしまう。結果として、P-700の吸収変化は真の値よりも低く見積もられてしまう(暗所で一部のP-700があらかじめ酸化されているため)。そこで、最大のシグナルを得られるまでTMPDの量を増加する。(※ただし必要量以上に加えると今度は励起光を照射した時にも十分な光酸化が起こらず、結果として再び吸収変化が小さくなる)
3.MV(光化学系Iの電子受容体:鉄イオウクラスタから電子を受け取る)の量
MVは、濃度が十分低い(1-3 μM)場合にはFA/FBからのみ電子を受け取るが、より高濃度の場合(>1 mM)はFxやA0,A1からも電子を受け取ることができる。光化学系Iの電子伝達鎖が無傷の場合、このプロトコル通りの10 μMで測定しても、より高濃度の10 mMで測定してもシグナルの大きさに差はみられない。しかし、仮にFA/FBが損傷していると、10 mMに比べて10 μMの時のほうがシグナルは小さくなる。つまり、10 μMと10 mMにおけるP-700光酸化量の差を調べることでPSIの電子伝達鎖の阻害状態を推測できる。
4.励起光の強さと色
クロロフィル蛍光の強さは励起光の強さに比例するが、P700の酸化は、ある励起光強度において飽和する。従って、クロロフィル蛍光による妨害が観察される場合、励起光はP700の光酸化がぎりぎり飽和する強さであることが望ましい。また、室温でのクロロフィル蛍光は、ほとんどが光化学系2に由来するので、シアノバクテリアなどのフィコビリンをアンテナ色素として持つ材料の場合は、励起光を通すフィルターに、CS 4-96に加えて東芝の色ガラスフィルタV-42を重ねると、フィコビリンの励起が減るために蛍光による妨害が減る。
参考文献
- Terashima I, Funayama S and Sonoike K (1994) Planta 193: 300-306 (このプロトコールの測定方法)
- Sonoike K and Katoh S (1990) Plant Cell Physiology 31: 1079-1082 (P-700の差分子吸光係数)